مخلوط ها (Mixtures)
مخلوط ها (Mixtures): مخلوط به موادی گفته می شود که از یکجا شدن دو و یا چند ماده مختلف تشکیل می گردد. در مخلوط ها اجزای تشکیل دهنده خواص کیمیاوی شان را حفظ نموده اما خصوصیات فزیکی مواد می توانند تغییر نمایند. مانند:نقطه غلیان، نقطه ذوبان، درجه انجماد، حالات فزیکی مواد وغیره.
طورمثال: از یکجا نمودن آب و الکول، مخلوطی به وجود می آید که نقطه جوش و ذوب آن نسبت به آب و الکول خالص متفاوت است. طوریکه، نقطه غلیان بالاتر و نقطه ذوبان کمتر از الکول خالص، اما نقطه جوش پایین و نقطه ذوبان بالاتر از آب خالص را دارد. همچنان با حل شدن بوره و یا نمک در آب، حالت فزیکی آنها تغییر کرده (از حالت جامد به آیونها و مالیکول ها پارچه می شوند) و تشکیل مخلوط (محلول) را می نمایند.
انواع مخلوط ها: مخلوط ها بر اساس اینکه ذرات تشکیل دهنده شان در بین هم در چه حالتی قرار می گیرند، به دو بخش دسته بندی می شوند.
- مخلوط متجانس (Homogeneous mixtures)
- مخلوط های غیر متجانس (Heterogeneous mixtures)
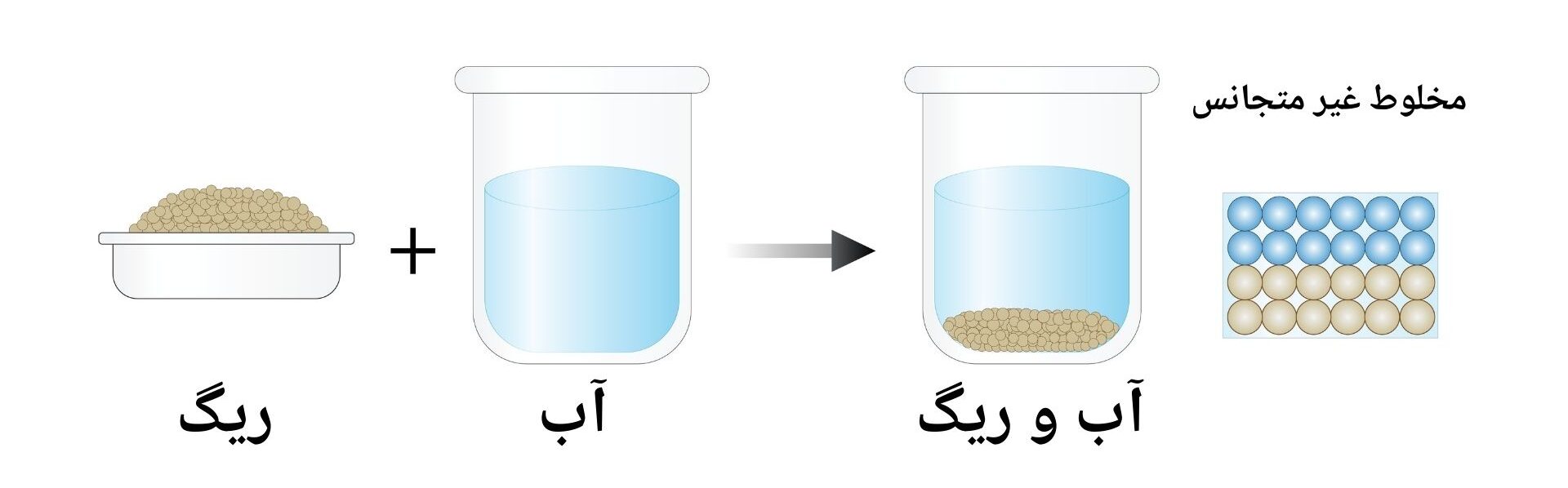
مخلوط غیر متجانس (Heterogeneous mixtures): به مخلوطی گفته می شود که اجزای تشکیل دهنده آن در تمامی قسمت های مخلوط دارای خواص یکسان نباشد و هر قسمتی از آن دارای خواص فزیکی متفاوت میباشد. در این صورت اجزای آن به راحتی قابل تفکیک بوده و همچنان ذرات آن به شکل لایه و طبقه از همدیگر قابل مشاهده اند.
طور مثال: مخلوط ریگ در آب نوعی از مخلوط متجانس می باشد که در شکل ذیل نشان داده شده است.
انواع مخلوط های غیر متجانس: مخلوط های غیر متجانس بر اساس اندازه ذرات تشکیل دهنده مخلوط به سه دسته تقسیم گردیده است.
کلوئیدها (Colloids): مخلوط (محلول) های کلوئیدی با چشم غیر مسلح به صورت یک مخلوط متجانس دیده میشود، اما اجزای تشکیل دهنده آن زیر مایکروسکوپ از یکدیگر جدا میباشند. اندازه ذرات کلوئیدی یبن ۱ تا ۱۰۰ نانومتر است. بعضا کلوئیدها یک حالت بین البینی بین مخلوط غیر متجانس و محلول در نظر گرفته می شوند.
ویژه گی اصلی کلوئیدی ها اثر تیندال (Tyndall effect) است، چون نور را پراگنده نموده و مسیر نور را قابل مشاهده میسازد. مثلا: اسپری مو، دود، خون و غیره. اجزای یک کلوئید را نمیتوان به روش (Decantation) از یکدیگر جدا کرد اما میتوان به کمک سانتریفوژ جدا نمود.
اثر تیندال (Tyndall Effect)، پراگندگی نور توسط ذرات در مخلوط کلوئیدی می باشد، این اثر به نام فزیک دان قرن نوزدهم، جان تیندال نامگذاری شده است.
روش (Decantation) یا ته نشینی روشی برای جدا کردن مایعات از جامدات بدون استفاده از فلتر می باشد.
سوسپنشن (Suspensions): نوعی از مخلوط های غیر متجانس اند که ماده منحله در آنها به صورت جامد و معلق باقی میماند. این ذرات در صورت هم زدن در مخلوط پراگنده میشوند، اما در غیر این صورت ته تشین می گردند. اندازه ذرات در این نوع مخلوط بزرگتر از یک میکرومتر است و به آسانی قابل مشاهده اند. نمونه های خوب آن ریگ در آب، شربت انتی بیوتیک آموکسی سیلین، شربت مگنیزیم برای معده، دوغ، سیماب در روغن (سمیاب در روغن یک سوسپنشن مایع در مایع را می سازد) می باشند.
در اشکال ذیل مخلوط ها بر اساس اندازه ذرات شان با هم مقاسیه شده اند.
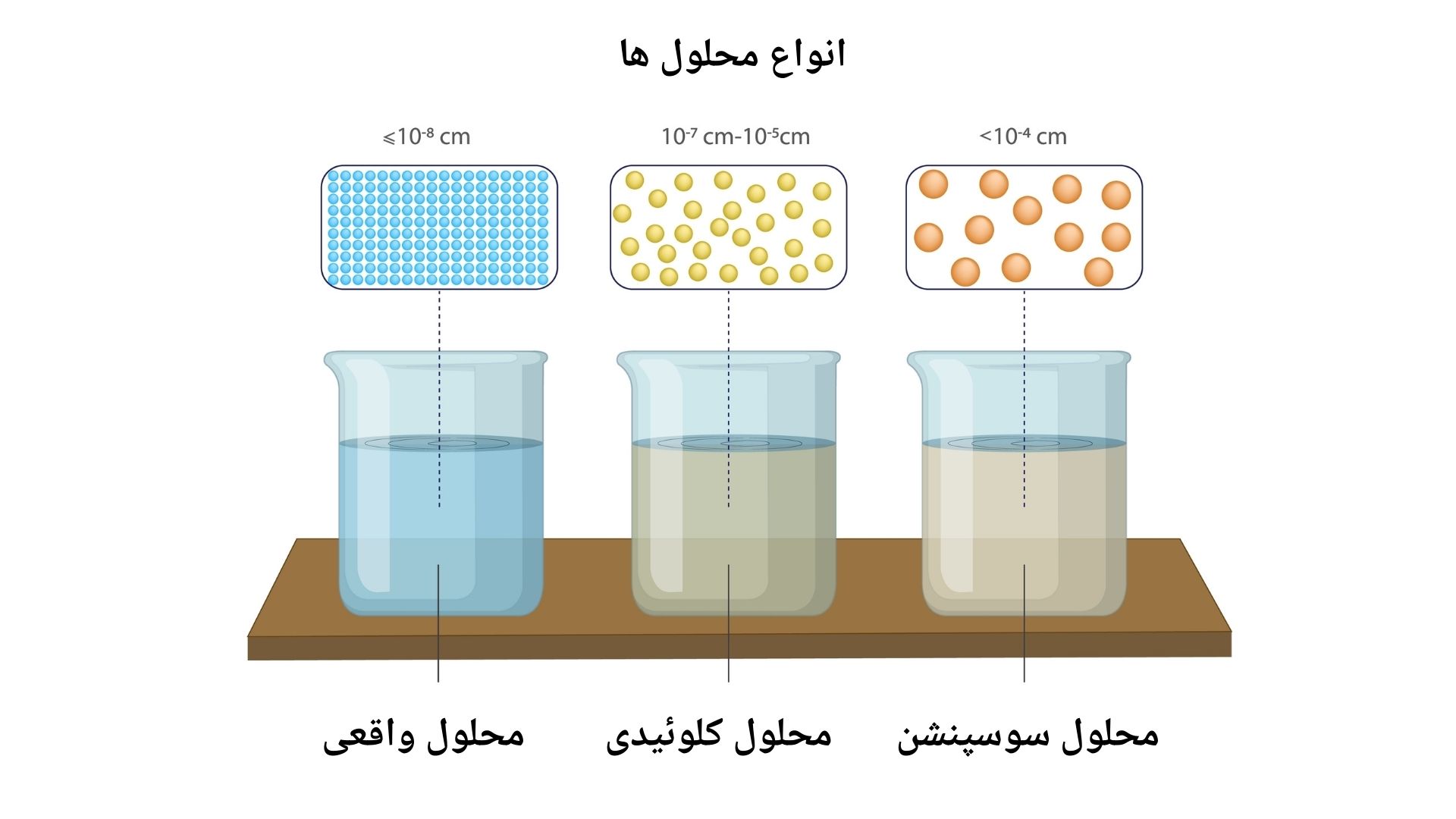
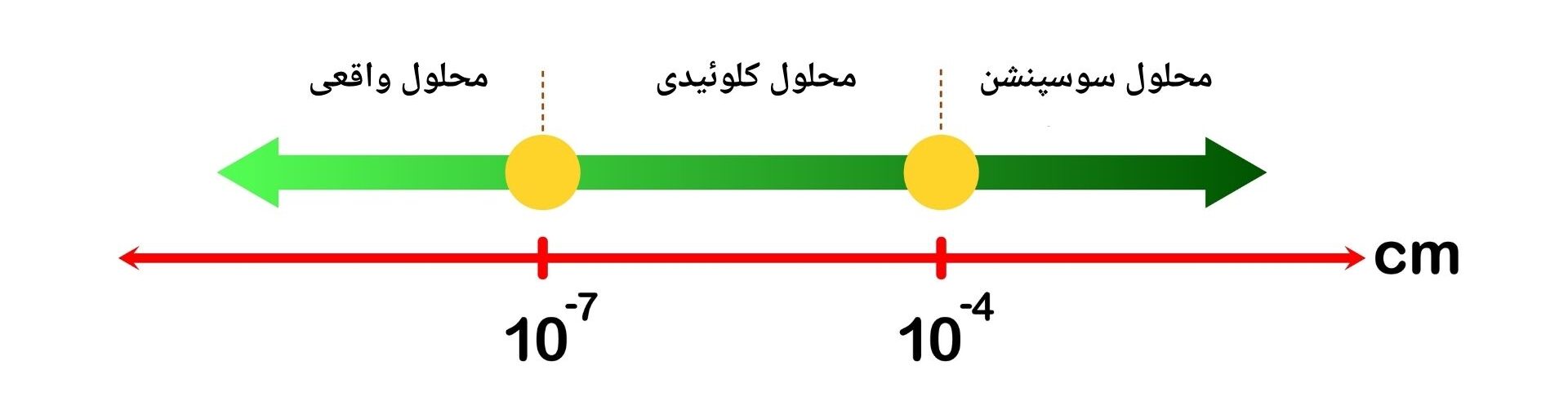 تبصره: اندازه ذرات در محلول واقعی کمتر از 8-10 سانتی متر است. ذرات به طور کامل در محلل حل شده و قابل مشاهده نیستند. اندازه ذرات در محلول کلوئیدی بین 7-10 تا 5-10 سانتی متر است. ذرات یکنواخت درحلال پخش شده اند، اما تحت مایکروسکوپ قابل مشاهده میباشد. اندازه ذرات در محلول های سوسپنشن بزرگتر از 4-10 سانتی متر اند ذرات به صورت معلق در ماده محلل پراگنده اند و در صورت عدم همزدن ته نشین میشوند.
تبصره: اندازه ذرات در محلول واقعی کمتر از 8-10 سانتی متر است. ذرات به طور کامل در محلل حل شده و قابل مشاهده نیستند. اندازه ذرات در محلول کلوئیدی بین 7-10 تا 5-10 سانتی متر است. ذرات یکنواخت درحلال پخش شده اند، اما تحت مایکروسکوپ قابل مشاهده میباشد. اندازه ذرات در محلول های سوسپنشن بزرگتر از 4-10 سانتی متر اند ذرات به صورت معلق در ماده محلل پراگنده اند و در صورت عدم همزدن ته نشین میشوند.
مخلوط متجانس (Homogeneous mixture)
نوعی از مخلوط های اند که اجزای تشکیل دهنده آن در تمام قسمت های مخلوط یکنواخت و یکسان میباشد و تمام قسمت های آن دارای عین خواص کیمیاوی و فزیکی بوده و یک فاز را تشکیل میدهد. مخلوط های متجانس را بنام محلول ها (Solutions) هم گویند. مثلا؛ محلول نمک در آب یک محلول و یک مخلوط متجانس است.
محلول ها (Solutions)
در گذشته بسیاری از دانشمندان و نظریه پردازان علم کیمیا و فزیک تحقیقات و مطالعات زیاد در مورد محلولها انجام داده اند، در تمدنهای باستانی مانند مصر، بابل و چین مردم از محلولها در بخش حل کردن موادهای معدنی، فلزات و استخراج آنها از محلولهای آبی استفاده میکردند، اگر چند این روش ها علمی نبودند اما زمینه ساز مطالعات بعدی در ارتباط به محلولها شدند. در قرون وسطی جابر بن حیان عملیه تقطیر و استخراج محلولها را توصیف کردند. در قرن بیست و بیستیکم با پیشرفتهای علمی و استفاده از ابزارهای جدید و توسعه یافته مانند؛ میکروسکوپهای الکترونی، روش های گروماتوگرافی و غیره امکان مطالعه دقیق تر محلول ها را فراهم ساختن و به دانشمندان کمک کردند تا ساختار مالیکولی و رفتاری محلولها را در سطح نانو، شناسایی و تجزیه و تحلیل کنند که باعث تحولات عمده در زمینه های مختلف چون دوا سازی، صنعت وغیره شده است.
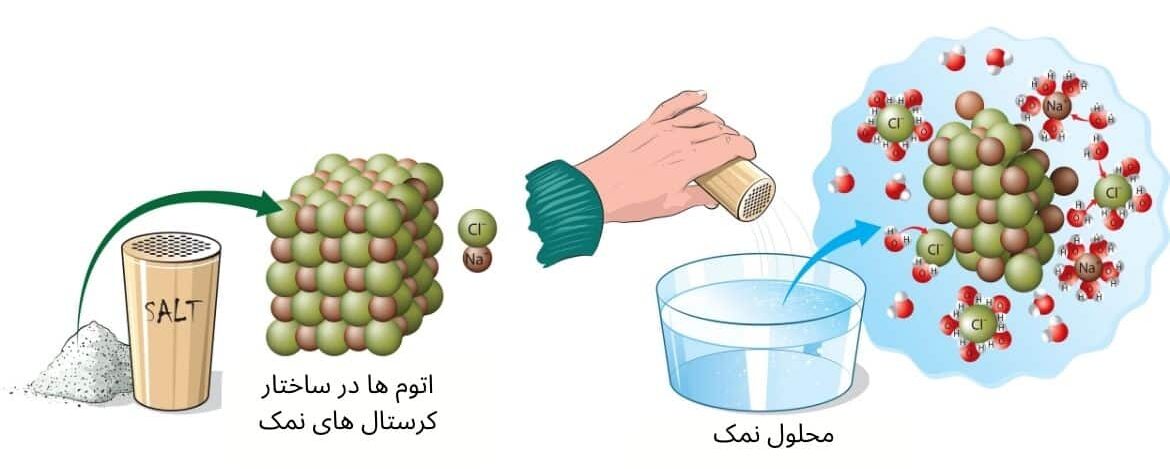 تعریف محلول: محلولها موادی اند که از یکجا شدن یک یا چند ماده حل شونده در مادهای حل کننده تشکیل میشوند. محلول ها از دو بخش ماده منحله (Solute) و محلل (Solvent) تشکیل شدهاند. دریک محلول مادهای که حل میشوند بنام ماده منحله (Solute) و مادهای که حل شونده را در خود حل میکنند بنام حلال یا محلل (Solvent) یاد می شود. به اجزای تشکیل دهنده محلول (Component) گفته می شود.
تعریف محلول: محلولها موادی اند که از یکجا شدن یک یا چند ماده حل شونده در مادهای حل کننده تشکیل میشوند. محلول ها از دو بخش ماده منحله (Solute) و محلل (Solvent) تشکیل شدهاند. دریک محلول مادهای که حل میشوند بنام ماده منحله (Solute) و مادهای که حل شونده را در خود حل میکنند بنام حلال یا محلل (Solvent) یاد می شود. به اجزای تشکیل دهنده محلول (Component) گفته می شود.
Solution=Solute+ Solvent
حل کننده + حل شونده = محلول
در محلول ها ذرات حل شونده در تمام قسمت های محلول یکسان و یکنواخت میباشد.
مانند: محلول نمک و آب، که در این محلول نمک ماده حل شونده و آب ماده حل کنندهاند.
انواع محلول ها
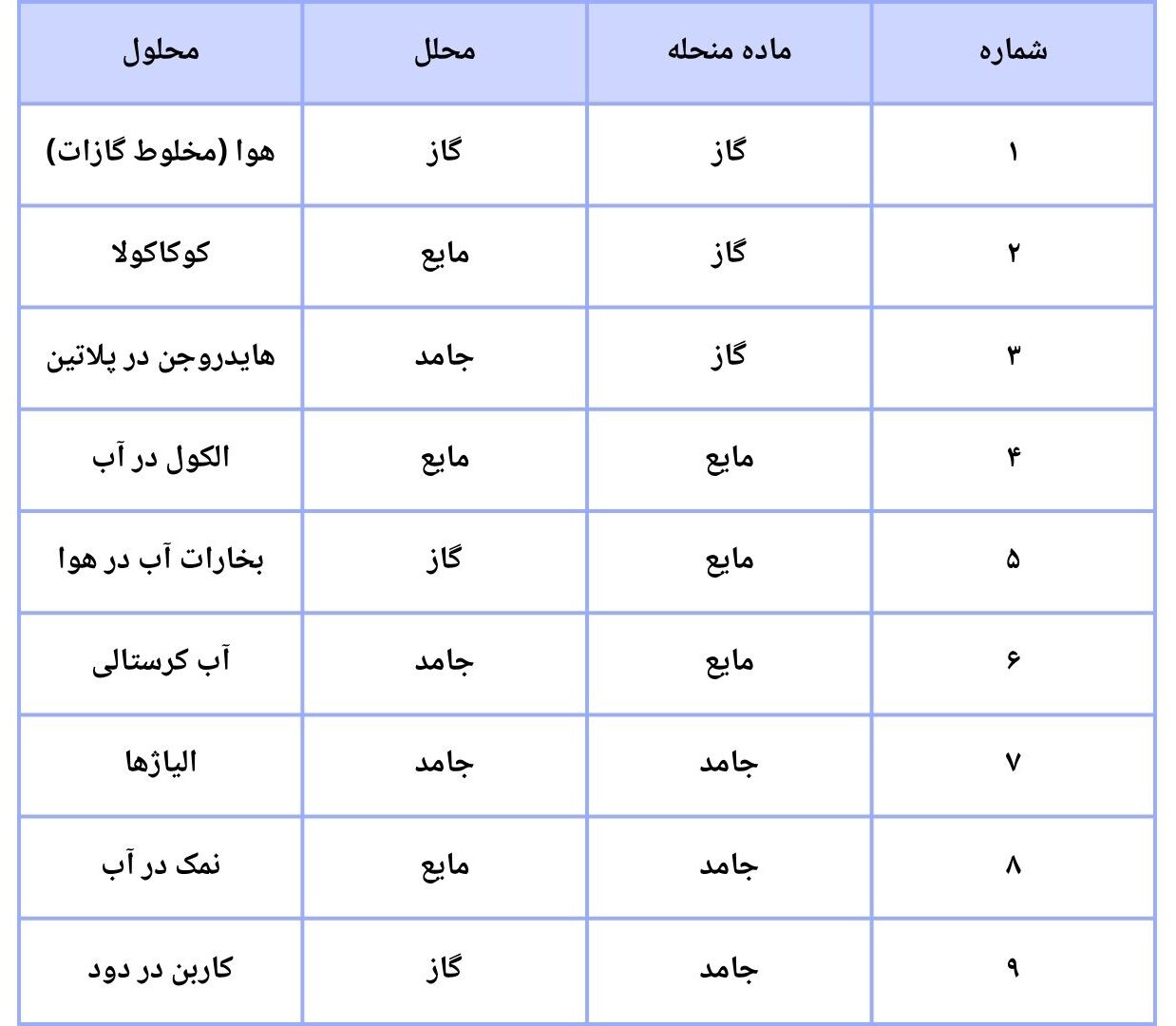
محلولها با در نظرداشت حالتهای فزیکی ماده منحله و محلل شان به اشکال مختلف تشکیل میشوند. محللها و ماده منحله میتوانند دارای سه حالت فزیکی مختلف ماده (گاز، مایع، جامد) باشند، که باعث تشکیل محلولها میشوند. به صورت عموم محلولها نظر به حالت فزیکی مواد تشکیل دهنده آنها به ۹ نوع اند که عبارتند از:
در این ویدیو-انیمشن نیز به تشریح مخلوط ها پرداخته شده است.