خواص کولیگاتیف محلول ها
خصوصیات محلول ها که به خواص کیمیاوی اجزای تشکیل دهنده آنها وابسته نباشند بلکه جز خواص فزیکی آنها باشند، را خواص کولیگاتیف می گویند. این خواص تحت تاثیرغلظت و حرکت ذرات اجزای محلول هستند که شامل: درجه ذوبان، درجه غلیان، درجه انجماد، تنزیل فشار بخار محلل در محلول، عملیه آسموس و فشار آزموتیک می باشند.
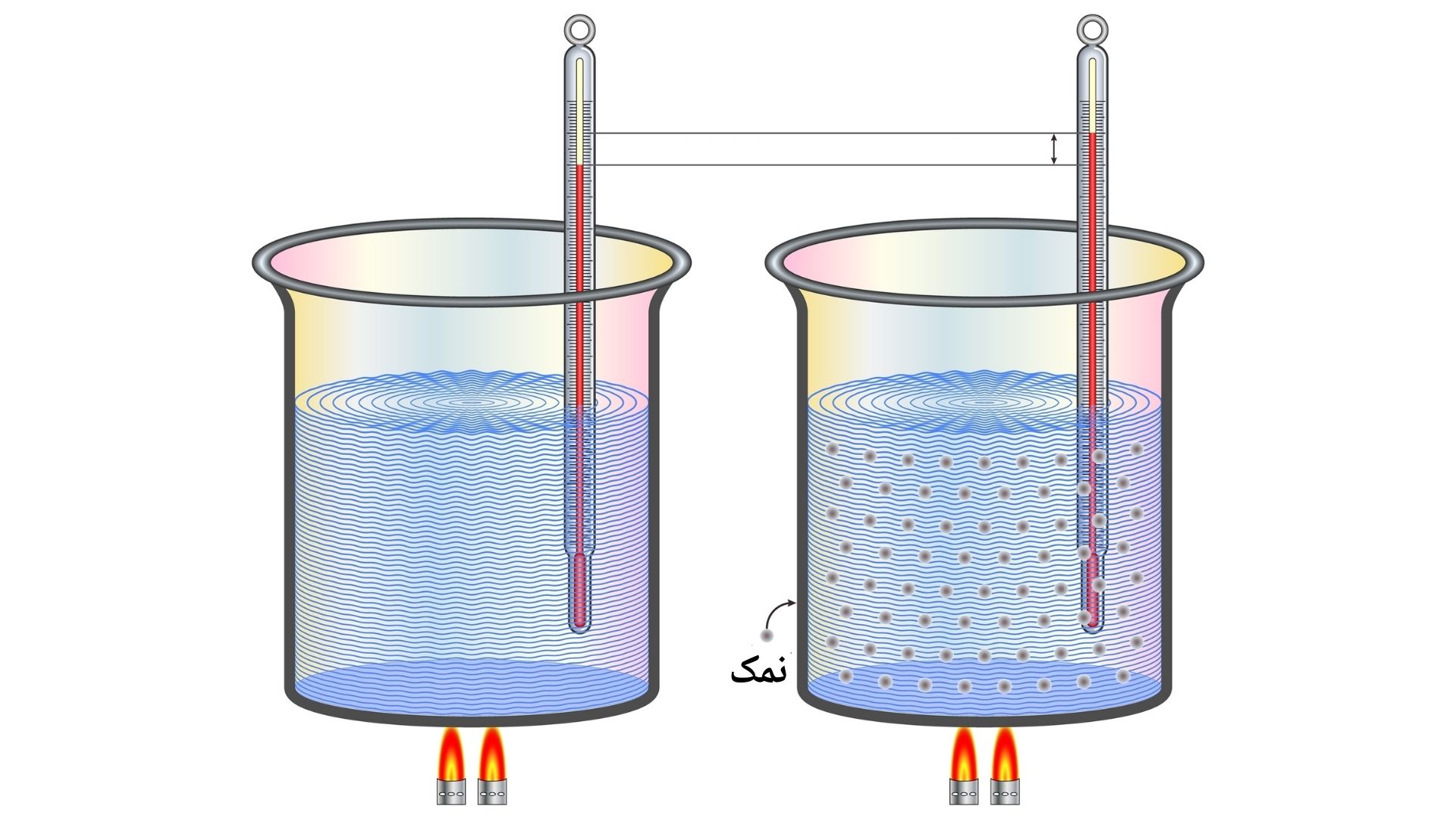
نقطه غلیان (Boiling Point): درجه غلیان به درجه حرارتی گفته می شود که یک ماده در آن به جوش می آید. درجه غلیان یک محلول با فشار بخار آن متناسب است. چون فشار بخار ماده محلل بیشتر از فشار بخار محلول آن است. یک ماده زمانی غلیان مینماید که فشار بخار داخلی آن مساوی به فشار محیط خارجی آن باشد. در محلول ها پایین آمدن فشار بخار محلل که از اثر ماده منحله میباشد، بالای درجه غلیان محلول های آن ها نیز تاثیر دارد. پس نقطه غلیان محلول ها بیشتر از نقطه غلیان محلل آن میباشد.
مثلا: آب در فشار یک اتمسفیر در حرارت ۱۰۰ درجه سانتیگراد به جوش می آید. وقتی بوره در آب حل شود فشار بخار آن کمتر از آب خالص است. بنابرین برای رساندن فشار بخار محلول به یک اتمسفیر مالیکول های آب باید قسمت های پایین به سطح بالاتر منتقل شوند. از آنجا که این مالیکول ها انرژی کمتری دارند، باید انرژی دریافت کنند تا به سطح آمده و تبخیر شوند. در نتیجه درجه غلیان محلول بیشتر از درجه غلیان محلل آن است. کاهش فشار بخار محلول ها سبب می شود که محلول تا زمانی که فشار داخلی بین ذرات آن با فشار خارجی برابر شود، گرم شود.
 درجه ذوبان ( Melting Point): درجه ذوبان به درجه حرارتی گفته می شود که در آن یک ماده از حالت جامد به مایع تبدیل می شود. درجه ذوبان برای بیشتر از مواد کیمیاوی با درجه انجماد (درجه حرارتی در آن یک ماده از فاز مایع به جامد تبدیل می شود) یکسان می باشد ولی هستند موادی که درجه غلیان و ذوبان متفاوت دارند. مثلا آب خالص در فشار 1 اتومسفیر به درجه حرارت °0C ذوب و انجماد می کند.
درجه ذوبان ( Melting Point): درجه ذوبان به درجه حرارتی گفته می شود که در آن یک ماده از حالت جامد به مایع تبدیل می شود. درجه ذوبان برای بیشتر از مواد کیمیاوی با درجه انجماد (درجه حرارتی در آن یک ماده از فاز مایع به جامد تبدیل می شود) یکسان می باشد ولی هستند موادی که درجه غلیان و ذوبان متفاوت دارند. مثلا آب خالص در فشار 1 اتومسفیر به درجه حرارت °0C ذوب و انجماد می کند.
نقطه ذوبان و انجماد برای تعدادی از مواد عضوی از خود تفاوت نشان می دهند. مثلا برای ماده آگر-آگر (Agar) که یک مرکب عضوی است به حرارت °85C ذوب شده ولی درجه انجماد پایین دارد که بین 30 الی 40 درجه سانتیگراد می باشد. همچنان درجه ذوبان و انجماد به تفسیر ما از تبدیل شدن مواد به فازهای جامد و مایع ارتباط دارد، طوریکه برای ذوب نمودن یک ماده به آن حرارت می دهیم و برای جامد ساختن آنرا سرد می سازیم.
نقطه ذوبان در محلول ها، با اضافه کردن یک ماده منحله کاهش میبابد. چون مالیکول های ماده منحله رابطه میان مالیکول های محلل را تضعیف ساخته و از تشکیل ساختار منظم جامد جلوگیری میکنند در نتیجه نقطه ذوبان کاهش میابد این کاهش درجه حرارت به مقدار و نوع ماده حل شونده بستگی دارد. مثلا:با مخلوط نمودن نمک با آب و یا یخ، درجه ذوبان تا 18- درجه سانتیگراد کم می شود، به همین علت در جاده های که یخبندان صورت می گیرد، نمک می باشند.
در تصویر ذیل آب تحت درجه حرارت های مختلف شان داده شده است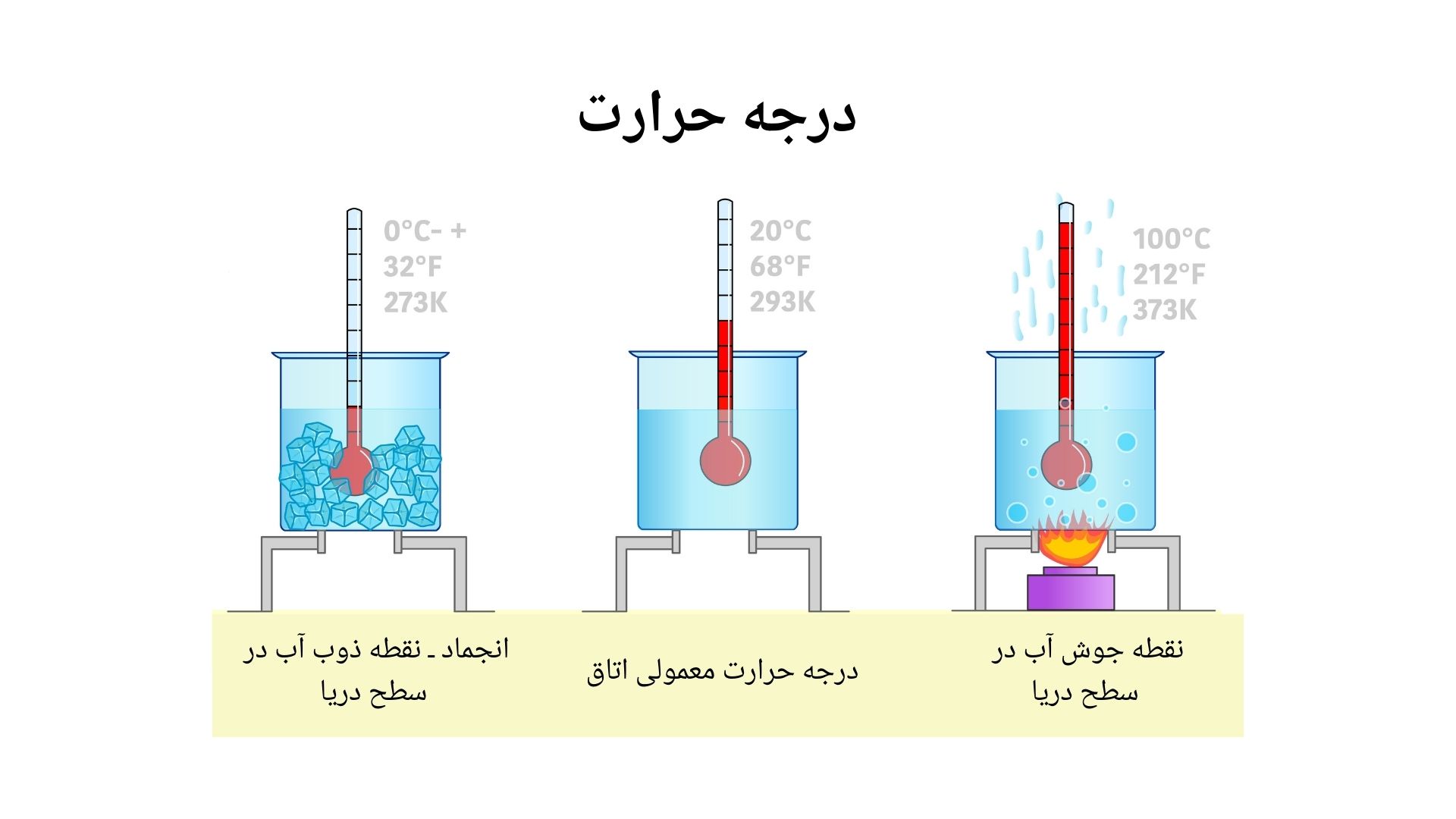 فشار بخار (Vapour Pressure): زمانیکه یک ماده منحله در حلال حل میشوند فشار بخار آن نسبت به زمانیکه یک ماده خالص است، کاهش مییابد. به طور مثال مقدار آب در یک ظرف (بدون وجود ماده منحله)، سرعت تبخیر سطحی بیشتر دارد، دلیل این امر این است که در مایع خالص تمام مالیکول های سطحی از خود مایع هستند و هیچ ماده دیگر برای اشغال سطح و کاهش تعداد مالیکول های قابل تبخیر وجود ندارد، در نتیجه تعداد بیشتر از مالیکول ها قادر به تبخیر شدن هستند و این باعث افزایش سرعت تبخیر میشود. در این حالت، فشار بخار نیز بیشتر است، زیرا فشار بخار به تعداد مالیکول های بخار شده در قسمت بالای مایع وابسته است. در مایع خالص، به دلیل بیشتر بودن مالیکول های قابل تبخیر در سطح، فشار بخار بالاتری دارند، اما زمانیکه یک ماده منحله در مایع حل میشود بعضی از ذرات سطحی به جای مالیکول مایع توسط ذرات ماده منحله اشغال میشوند. این امر باعث کاهش تبخیر مالیکول های مایع در سطح شده و سرعت تبخیر را کاهش میدهد. در نتیجه فشار بخار نیز کاهش یافته زیرا تعداد کمتر از مالیکول ها به بخار تبدیل میشوند. علامت احتصاری فشار بخار قرار ذیل میباشد. vP یا vapP
فشار بخار (Vapour Pressure): زمانیکه یک ماده منحله در حلال حل میشوند فشار بخار آن نسبت به زمانیکه یک ماده خالص است، کاهش مییابد. به طور مثال مقدار آب در یک ظرف (بدون وجود ماده منحله)، سرعت تبخیر سطحی بیشتر دارد، دلیل این امر این است که در مایع خالص تمام مالیکول های سطحی از خود مایع هستند و هیچ ماده دیگر برای اشغال سطح و کاهش تعداد مالیکول های قابل تبخیر وجود ندارد، در نتیجه تعداد بیشتر از مالیکول ها قادر به تبخیر شدن هستند و این باعث افزایش سرعت تبخیر میشود. در این حالت، فشار بخار نیز بیشتر است، زیرا فشار بخار به تعداد مالیکول های بخار شده در قسمت بالای مایع وابسته است. در مایع خالص، به دلیل بیشتر بودن مالیکول های قابل تبخیر در سطح، فشار بخار بالاتری دارند، اما زمانیکه یک ماده منحله در مایع حل میشود بعضی از ذرات سطحی به جای مالیکول مایع توسط ذرات ماده منحله اشغال میشوند. این امر باعث کاهش تبخیر مالیکول های مایع در سطح شده و سرعت تبخیر را کاهش میدهد. در نتیجه فشار بخار نیز کاهش یافته زیرا تعداد کمتر از مالیکول ها به بخار تبدیل میشوند. علامت احتصاری فشار بخار قرار ذیل میباشد. vP یا vapP
تصاویر ذیل نشان دهنده فشار بخار محلل در محلل خالص و محلول می باشند.
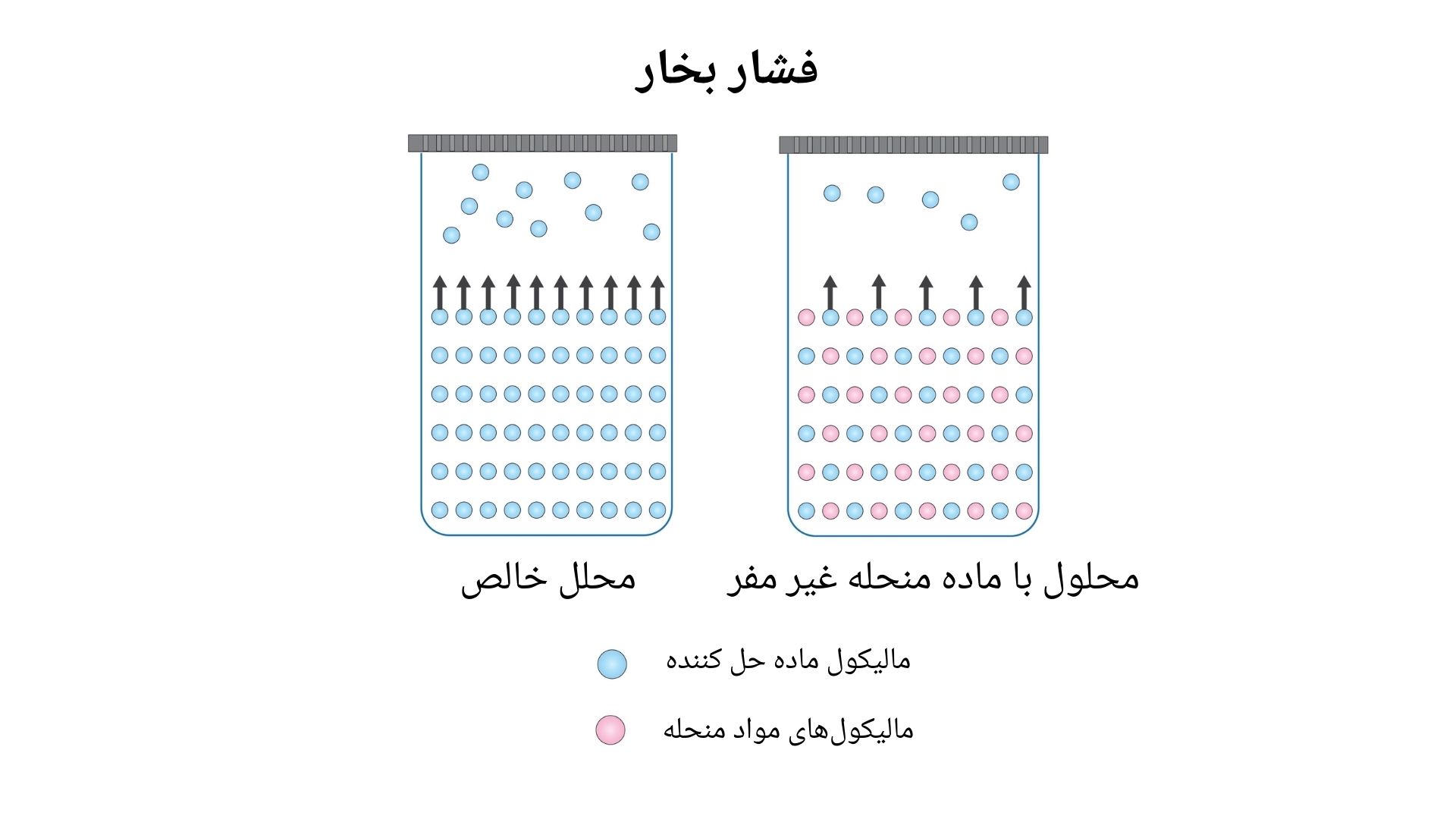 دانشمندی به نام راولت (Raoult) با مطالعه نمودن فشار بخار محلول های رقیق دریافت که فشار بخار محلل در موجودیت ماده منحله به طور مستقیم متناسب است با غلظت ماده محلل:
دانشمندی به نام راولت (Raoult) با مطالعه نمودن فشار بخار محلول های رقیق دریافت که فشار بخار محلل در موجودیت ماده منحله به طور مستقیم متناسب است با غلظت ماده محلل:
P=P0N1
که در آن:
- P فشار بخار محلول است.
- P0 فشار بخار محلل خالص است.
- N1 نسبت مولی ماده محلل است.
اما فشار بخار مجموعی
P = PA XA + PB XB
که در اینجا:
P = فشار بخار محلول (ماده منحله و محلل)
X = کسر مولی (محلل و ماده منحله)
PA = فشار ماده محلل
PB = فشار ماده منحله
دروس مرتبط با عملیه آسموس و فشار آسموتیک را با کلیک در اینجا می توانید بخوانید.
در ادامه به روش های جداسازی اجرای مخلوط ها پرداخته شده است که هرکدام توسط یک فعالیت عملی نشان داده شده اند.
1- جدا سازی اجزای مخلوط ها به روش ته نشینی.
2- جدا سازی اجزای مخلوط ها به روش فلتریشن.
3- جدا سازی اجزای مخلوط ها به روش چیدن و غربال کردن.
4- جدا سازی اجزای مخلوط ها به روش تبخیر.
5 – جداسازی اجزای مخلوطها به روش قیفتفریقی.
