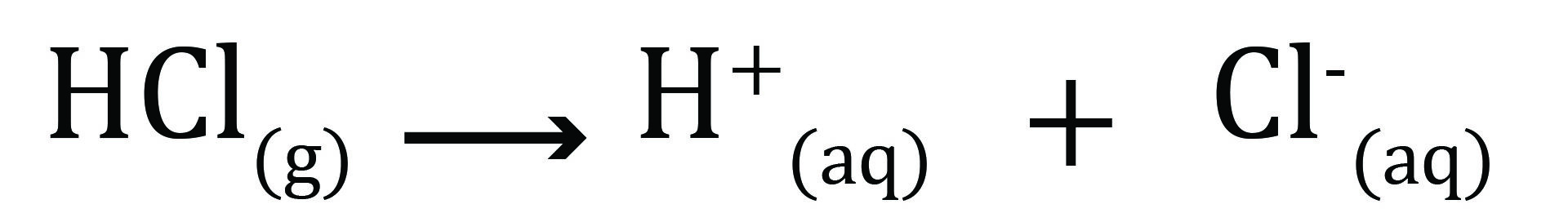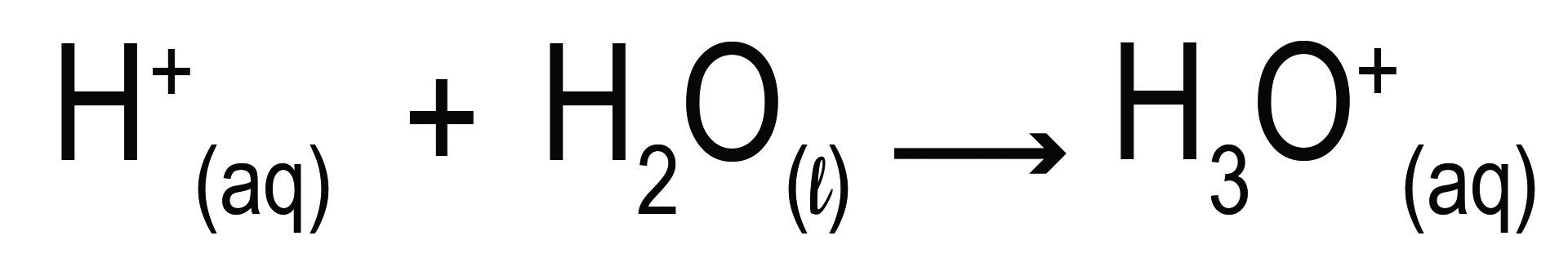تیزاب ها و قلوی ها (Acid and Base)
تیزاب ها (Acids): مرکباتی اند که در محلول آبی شان تولید پروتون (آیون+H) می نمایند و یا مرکبات اند که در تعاملات کیمیاوی به عنوان گیرنده جوره الکترون عمل می کنند. چند نمونه از تیزاب هاب معمول عبارتند از: تیزاب سرکه (استیک اسید، CH3COOH)، تیزاب معده ( هایدروکلوریک اسید، HCl) و تیزاب لیمو (سیتریک اسید،C6H8O7). تیزاب از کلمه لاتین اسیدوس (Acidus) گرفته شده که معنی ترش را میدهد، دارای خاصیت خورندگی بوده، معرف ها (اندیکاتورها) را تغییر رنگ میدهند و القلی ها را خنثی می کنند، تیزاب ها دارای ذایقه ترش اند.
قلویها(Bases):گیرنده پروتون (آیون+H) و یا دهنده جوره الکترون میباشند. مانند:آمونیا (NH3)، سودیم هایدروکساید(NaOH)، جوش شیرین (سودیم بای کاربونت، NaHCO3)، پوتاشیوم هایدوکساید (KOH) و غیره
قلوی (Base) از کلمه قدیمی انگلیسی (Debase) به معنای کاهش یا کاستن گرفته شده اند. زمانیکه تیزاب ها و قلوی ها به نسبت های معین با هم ترکیب شوند، قلوی ها سبب کاهش مقداری از تیزاب ها در محلول مربوطه میشوند،که به اصطلاح (Debase) مطابقت میکند. القلی ها دارای مزه تلخ اند و محلول آبی القلی ها لشم اند.
قلوی ها کمتر در آب منحل می باشند، به تعدادی از قلوی هایکه در آب منحل اند، القلی گفته می شوند. مانند: سودیم هایدرکساید، پوتاشیوم هایدرکساید و امونیا.
تیزاب ها و القلی ها با در نظر داشت خواص مختلفی که از خود نشان می دهند، و همچنین نظر به عملکرد های متفاوت شان، توسط دانشمندان به روش های ذیل تعریف شده اند:
تعریف تیزاب ها و القلی ها به اساس نظریه سوانت ارهینوس (Svante Arrhenius)
تیزاب ها مرکبات اند که در محلول آبی شان آیون هایدروجن (+H) را آزاد می کنند. آیون های هایدورجن(+H) به صورت آزاد در محلول وجود نداشته بلکه تبدیل به آیون هایدرونیوم (+H3O) میشوند.
در معادلات ذیل، هایدروکلوریک اسید در محلول آبی آن نشان داده شده است.
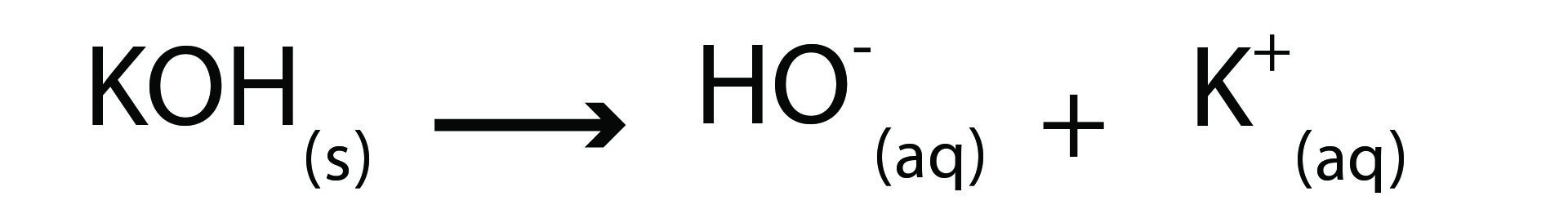
القلی ها مرکبات اند که در محلول های آبی شان آیون هایدروکساید (–OH) را آزاد می کنند. این تعریف فقط به موادی محدود میشود که در آب قابل حل باشند. (یکی از اشکالات تعریف تیزاب ها و القلی ها به اساس نظر ارهینوس همین است).
در معادله ذیل، القلی پوتاشیوم هایدروکساید در محلول آبی آن نشان داده شده است.
 تعریف تیزاب ها و القلی ها به اساس نظریه برونستید – لوری (Bronsted-Lowry)
تعریف تیزاب ها و القلی ها به اساس نظریه برونستید – لوری (Bronsted-Lowry)
طبق نظریه برونستید- لوری تیزاب ها موادی اند که در تعاملات کیمیاوی به عنوان دهنده پروتون (+H) و القلی ها در تعامل کیمیاوی به عنوان گیرنده پروتون (+H) عمل میکنند. که از این نظریه بر خلاف تعریف ارهینوس می توان در محیط غیر آبی نیز استفاده کرد.
مانند:
 در این تعامل HCl به عنوان اسید برونستد- لوری عمل میکند بخاطراینکه پروتون را اهدا میکند و NH3 به عنوان قلوی برونستد -لوری عمل کرده زیرا گیرنده پروتون میباشد.
در این تعامل HCl به عنوان اسید برونستد- لوری عمل میکند بخاطراینکه پروتون را اهدا میکند و NH3 به عنوان قلوی برونستد -لوری عمل کرده زیرا گیرنده پروتون میباشد.
در معادله کیمیاوی ذیل، آب و آمونیا بر اساس تعریف برونستید-لوری به عنوان اسید و القلی، تعریف شده اند.
 در اینجا آب به عنوان تیزاب برونستد-لوری که دهنده پروتون میباشد و NH3 به عنوان قلوی برونستید-لوری عمل میکند زیرا پروتون گیرنده میباشد.
در اینجا آب به عنوان تیزاب برونستد-لوری که دهنده پروتون میباشد و NH3 به عنوان قلوی برونستید-لوری عمل میکند زیرا پروتون گیرنده میباشد.
تعریف تیزاب ها و القلی ها به اساس نظریه گیلبرت نیوتون لیوس (Gilbert Newton Lewis)
القلی ها موادی اند که می تواند جوره الکترون های آزاد خود را از دست بدهند و تیزاب ها موادی اند که جوره الکترون را به خود بگیرند.
به طور مثال:
+H به عنوان اسید لویس عمل میکند زیرا جفت الکترون را از H2O میگیرند.
H2O به دلیل دادن یک جوره الکترون های به عنوان قلوی لویس عمل میکند.
نوت: بسیاری از کتیون ها مانند Al+3 می تواند به عنوان تیزاب لویس عمل کنند درحالی که بسیار از انیون ها مانند–F میتواند به عنوان القلی لویس عمل کنند.
خواص تیزاب ها و القلی ها: در جدول ذیل با در نظرداشت خصوصیات فیزیکی و کیمیاوی، به بیان تعدادی از تفاوت های بین تیزاب و القلی اشاره شده است.