مقیاس pH و pOH
pH (Power of Hydrogen)
در واقع منفی لوگاریتم غلظت آیون هایدرونیوم در یک محلول است که توسط دانشمند بنام سورن سورنسن (Soren Sorensen) کیمیا دان دانمارکی این مقیاس پیشنهاد گردید.
pH= -Log|H3O+|
[H3O+]= 10-pH
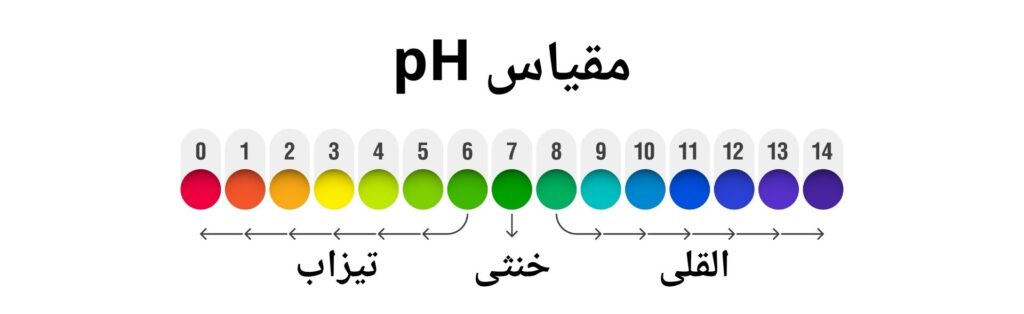
مقیاس pH برای درجه بندی و تشخیص محلول ها از نگاه اسیدی و قلوی بودن شان استفاده میشود. مقیاس pH از 0 تا 14 درجه بندی شده است. دلیل انتخاب مقیاس از (0-14) این است که آیون هایدروجن در محلول های آبی غلظتی بین یک مو لار (1M) تا 14-10 مولار دارد و در برخی محلول ها غلظت آیون هایدروجن کمتر و یا بیشتر از این میباشد.
اگر 7 < pH باشد، محلول قلوی است یعنی غلظت آیون هایدروکسیل بیشتر از آیون هایدرونیم اند.
اگر 7 > pH باشد، محلول اسیدی خواهد بود یعنی غلظت آیون هایدرونیم بیشتر از آیون هایدروکسیل میباشد.
اگر 7 = pH باشد، محلول خنثی بوده به این معنی که غلظت آیون های هایدروکسیل و هایدرونیون با یکدیگر برابراند.
هر قدر در محلول قیمت مقیاس pH نزدیک به 7 را داشته باشد خاصیت اسیدی و القلی بودن کمتر را دارا میباشد.
تصویر ذیل نشان دهنده مقیاس pH برای محیط های مختلف تیزابی، القلی و خنثی می باشد.
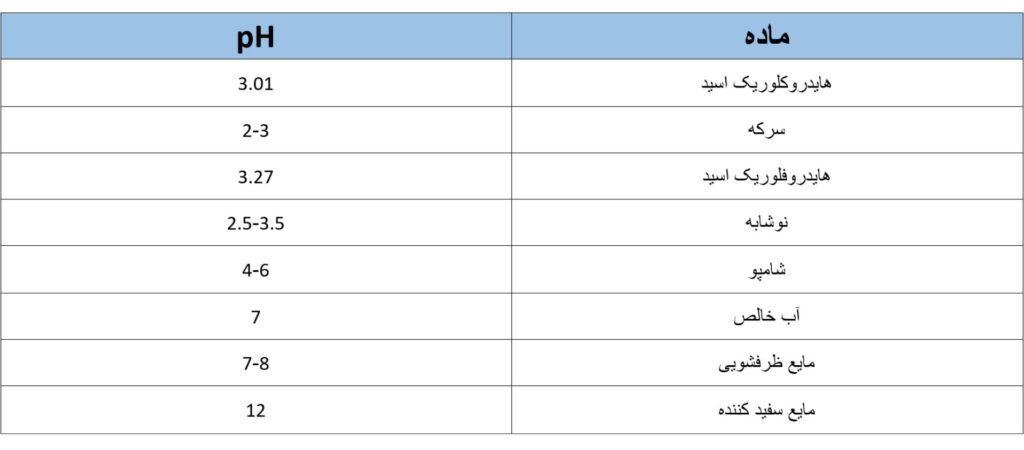
در جدول ذیل pH برای بعضی از مواد نشان داده شده است.
در تصویر ذیل اندازه pH تعدادی از مواد و خوراکی های نشان داده شده اند که در زندگی روزمره با آنها سروکار داریم.
مقیاس pOH (Power of Hydroxide)
pOH منفی لوگارتم غلظت آیون هایدروکسیل است که قرار معادله زیر مینوسیم:
pOH= -log (OH)
[OH–]=10-pOH
از معادله آیونایزیشن خود به خودی آب رابطه بین pH و pOH را دریافت کرده میتوانیم.
[H3O+][OH–] = 1.0 x 10-14
pH + pOH = 14 = pH + pOH = 14
pOH =14 – pH
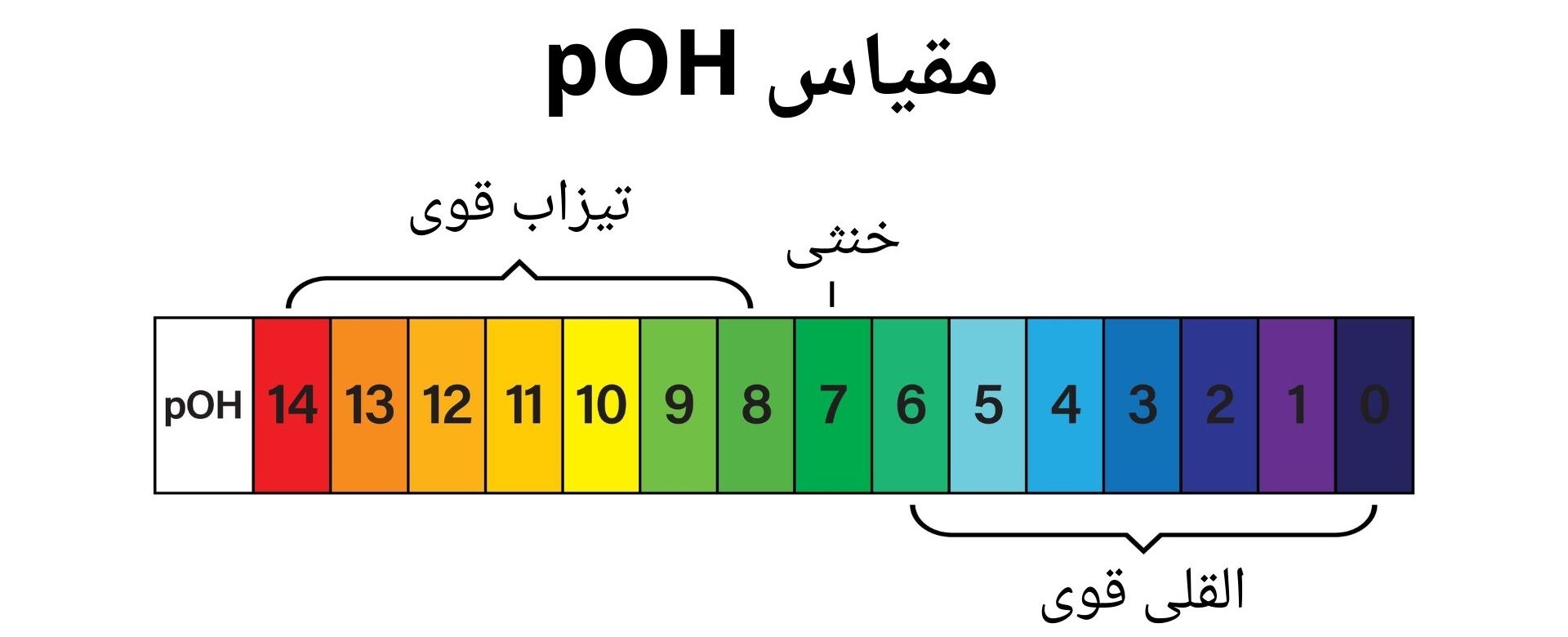
در pOH = 0 محلول قلوی قوی بوده، غلظت آیون (–OH) زیاد میباشد.
در صورتیکه pOH = 7 باشد محلول خنثی میباشد.
اگر pOH = 14 باشد محلول تیزابی میباشد یعنی غلظت موجود آیون هایدروکسیل در محلول کم میباشد.
در تصویر ذیل مقیاس pOH نشان داده شده است.
پی اچ متر (pH-meter)
وسیله ای است که برای اندازه گیری میزان تیزابی بودن و یا القلی بودن محلول ها یا مواد استفاده می گردد. این دستگاه به وسیله حس گرها (الکترودها) میزان غلظت محلول را در یک صفحه دیجیتالی به نمایش می گذارد، طوریکه حس گرها در محلول فرو برده شده و اندازه pH محلول در صفحه نمایش داده می شود.
در تصاویر ذیل دو نوعی از pH متر نشان داده شده اند: