طبقهبندی معاصر
جدولتناوبیعناصر (Periodic table of elements) که به آن جدول مندلیف هم گفته میشود، عناصر را براساس نمبراتومی، آرایش الکترونی و خواص کیمیاوی آنها دستهبندی میکند. این جدول به درک بهتر خواص عناصر و پیشبینی رفتار آنها کمک مینماید.
جدولتناوبی از ۱۸ گروه (ستون عمودی) و ۷ دوره (ردیف افقی) تشکیل شده است که در ادامه به تشریح آنها میپردازیم.
قرار ذیل شما میتوانید جدیدترین جدولدورانیعناصر را به زبان دری – فارسی، مشاهده و دانلود نمایید.
تناوبها در جدولدورانیعناصر
جدولدورانیعناصر دارای هفت دوره یا قطار افقی میباشد که قرار ذیل توسط عناصر تکمیل شدهاند:
- در پِریود اول جدول ۲ عنصر شامل میشود. هایدروجن و هلیوم
- در تناوب دوم ۸ عنصر شامل میشود که با فلز لیتیوم شروع و به گازنجیب نیون ختم میگردد.
- در پِریود سوم نیز ۸ عنصر شامل میباشند که فلز سودیم شروع و با گازنجیب ارگون ختم میشود.
- در تناوب چهارم ۱۸ عنصر شامل میباشند که با عنصر پوتاشیوم آغاز و با گازنجیب کریپتون ختم میشود.
- در تناوب پنجم ۱۸ عنصر شامل میشود که با فلز روبیدیوم آغاز و با غیرفلز یا گازنجیب زینون ختم میشود.
- در پِریود ششم ۳۲ عنصر شامل میشود که با فلز سیزیم شروع و به گازنجیب رادون ختم میگردد. اما ۱۴ عنصر شامل این دوره به صورت جداگانه در قسمت پایین جدول نمایش داده میشوند که بنام سلسله لنتانایدها یاد میگردند. دلایل جدا نمودن لنتانایدها از دوره ششم در ادامه توضیح داده شده است.
- دوره هفتم جدولدورانی عناصر نیز شامل ۳۲ عنصر میباشد. این دوره با فلز فرانسیوم آغاز و با عنصر اوگاسون (عنصر اوگاسون یک عنصر ناپایدار بوده و مشاهده خواص کیمیاوی آن کار مشکلی است اما به لحاظ ساختار الکترونی قشر آخر آن در گروه هشتم اصلی (هجدهم) قرار گرفته است). از میان عناصر شامل دورهٔ هفتم ۱۴ عنصر آن در قسمت پایین جدول به صورت جداگانه نمایش داده میشوند که بنام سلسله اکتینایدها یاد میگردند.
دلایل ذیل را میتوانیم برای جدا نمایش دادن لنتانایدها و اکتینایدها از دورههای ششم و هفتم بیان نماییم:
- محدودیت فضای کافی در جدول. هرگاه این دو مجموعه از عناصر در دورهها نمایش داده شوند، جدول گسترده شده و نمای مناسب خود را از دست می دهد.
- لنتانایدها و اکتینایدها به لحاظ مشابهت خواص کیمیاوی باهم نزدیک میباشند، از اینرو نمایش آنها به صورت جداگانه قابل فهمتر میباشد.
- در تقسمیات الکترونی سویههای فرعی f در این عناصر الکترون میگیرند.
به طور خلاصه، قرار دادن لنتانیدها و اکتینایدها در پایین جدولتناوبی، هم به دلیل محدودیت فضا و هم به دلیل نمایش بهتر خواص کیمیاوی آنها است.
ساختار جدولدورانیعناصر با حفظ لنتانایدها و اکتینایدها در دورهها. برای دانلود با اندازهٔ بزرگ، روی تصویر کلیک نمایید.
برای عناصر شامل عین دوره میتوانیم خصوصیات مشترک ذیل را بیان داریم:
- عناصر شامل عین دوره تعداد مساوی قشرها یا مدارهای الکترونی را دارا میباشند. طورمثال: عناصر شامل دورهٔ چهارم، هر کدام دارای چهار مدارالکترونی در اطراف هسته اتومهایشان میباشند.
- هر دوره با یک فلز فعال آغاز و به یک گازنجیب (کمتر فعال در تعاملات کیمیاوی) ختم میگردد. به استثنای دورهٔ هفتم که به یک عنصر ناپایدار(اوگاسون) ختم میشود.
- خاصیت فلزی در یک دوره به تدریج از چپ به راست کاهش و خاصیت غیرفلزی افرایش پیدا میکند.
- اندازهٔ اتومها به تدریج از چپ به راست کاهش مییابد.
- تعداد الکترونهای ولانسی از چپ به راست افزایش مییابد. طور مثال: فلز سودیم در دورهٔ سوم دارای یک الکترونولانسی و عنصر هم دورهٔ آن، کلورین در طرف راست جدول دارای هفت الکترون ولانسی میباشد.
تعدادی دیگری از خصوصیات عناصر شامل عین دوره، در ادامه با تفصیل بحث شدهاند.
گروهها در جدولدورانیعناصر
هفت دوره یا ردیفهای افقی در جدولدورانیعناصر، متشکل از ۱۸ ستون عمودی یا گروهها (دستهها) میباشند. عناصر در گروهها براساس مشابهت خواص کیمیاویشان قرار میگیرند.
گروههای جدولتناوبی به دو دسته اصلی و فرعی تقسیم میشوند:
- گروههای اصلی (Main groups): شامل گروههای ۱ الی ۲، و ۱۳ الی ۱۸ میباشند. این گروهها عناصری را دربر میگیرند که قشرالکترونی فرعی s در آنها در حال پر شدن است.
- گروههای فرعی (Transition metals): شامل گروههای ۳ تا ۱۲ میباشند. این گروهها عناصری را دربر میگیرند که لایه d آنها در حال پر شدن است. همچنین، لنتانیدها و اکتینایدها نیز جز گروههای فرعی محسوب میشوند.
در مجموع، جدولدورانیعناصر شامل ۸ گروه اصلی (A) و 10 گروه فرعی (B) است.
نکته: دسته بندی گروه ها به اصلی و فرعی امروز زیاد مورد بحث نیست و سیستم بین المللی (آیوپاک) تعداد گروه ها را در جدول دورانی عناصر در کل شامل 18 ستون بیان می دارد.
گروههای اصلی (Main groups):
این گروهها شامل گروههای ۱ الی ۲، و ۱۳ الی ۱۸ میباشند و عناصری را دربر میگیرند که قشرالکترونی فرعی s و p در آنها در حال پر شدن است. تعدادی از گروههای اصلی در جدولدورانیعناصر به نامهای مشخص یاد میگردد.
در جدول ذیل این موضوع با انتخاب رنگهای مختلف برای هرگروه بیان شدهاند.
 قرار ذیل به تشریح دلایل نام گذاری گروههای اصلی و بعضی خصوصیات آنها، میپردازیم:
قرار ذیل به تشریح دلایل نام گذاری گروههای اصلی و بعضی خصوصیات آنها، میپردازیم:
گروه اول اصلی (IA) که شامل فلزات: لیتیوم(Li)، سودیم(Na)، پوتاشیوم(K)، روبیدیوم(Rb)، سیزیم(Cs) و فرانسیوم(Fr) میشوند، بنام فلزاتالقلی یاد میگردند. این عناصر بنابر فعالیت کیمیاوی فوقالعادهشان، به شدت با آب تعامل نموده و قلوی(القلی)ها را تشکیل میدهند. مانند: سودیم هایدروکساید و پوتاشیوم هایدروکساید.
 عنصر هایدروجن در گروهٔ اول اصلی قرار گرفته است، تنها دلیل مقنع برای این موقعیت، شباهت ساختار الکترونی هایدروجن با سایر عناصر این گروه میباشد. مشابه با فلزاتالقلی شامل گروه اول، هایدروجن دارای یک الکترونولانسی میباشد. در غیر آن به لحاظ سایر خواص با فلزاتالقلی شباهت خاصی ندارد و خصوصیات منحصر به فرد خود را دارد.
عنصر هایدروجن در گروهٔ اول اصلی قرار گرفته است، تنها دلیل مقنع برای این موقعیت، شباهت ساختار الکترونی هایدروجن با سایر عناصر این گروه میباشد. مشابه با فلزاتالقلی شامل گروه اول، هایدروجن دارای یک الکترونولانسی میباشد. در غیر آن به لحاظ سایر خواص با فلزاتالقلی شباهت خاصی ندارد و خصوصیات منحصر به فرد خود را دارد.
 گروه دوم اصلی (IIA) که شامل فلزات: بریلیم(Be)، مگنیزیم(Mg)، کلسیم(Ca)، سترانشیوم(Sr)، باریوم(Ba) و رادیوم(Ra) میشوند، بنام فلزاتالقلی زمینی یاد میگردند. عناصر شامل این گروه نیز با آب تعامل نموده، اما شدت جریان تعامل آنها نسبتاً ضعیفتر بوده و تشکیل قلویهای ضعیفتری را مینمایند.
گروه دوم اصلی (IIA) که شامل فلزات: بریلیم(Be)، مگنیزیم(Mg)، کلسیم(Ca)، سترانشیوم(Sr)، باریوم(Ba) و رادیوم(Ra) میشوند، بنام فلزاتالقلی زمینی یاد میگردند. عناصر شامل این گروه نیز با آب تعامل نموده، اما شدت جریان تعامل آنها نسبتاً ضعیفتر بوده و تشکیل قلویهای ضعیفتری را مینمایند.
 گروهٔ سوم اصلی(IIIA) که شامل عناصر: بورون، المونیوم(Al)، گالیوم(Ga)، اندیوم(In)، تالیوم(Tl) و نِهونیوم(Nh) میشوند، بنام گروه بورون و یا هم فلزاتزمینی یاد میگردند. دلیل اینکه این گروه با عنوان فلزاتزمینی یاد میشود، وجود عنصر المونیوم است که فراوانترین فلز در پستهٔزمین میباشد و اینکه بنام گروه بورون یاد میشوند این است که اولین عنصر این گروه بورون میباشد.
گروهٔ سوم اصلی(IIIA) که شامل عناصر: بورون، المونیوم(Al)، گالیوم(Ga)، اندیوم(In)، تالیوم(Tl) و نِهونیوم(Nh) میشوند، بنام گروه بورون و یا هم فلزاتزمینی یاد میگردند. دلیل اینکه این گروه با عنوان فلزاتزمینی یاد میشود، وجود عنصر المونیوم است که فراوانترین فلز در پستهٔزمین میباشد و اینکه بنام گروه بورون یاد میشوند این است که اولین عنصر این گروه بورون میباشد.
گروه ۱۴ یا چهارم اصلی (IVA) بنام، گروه کاربن (C) یاد میشود، چون اولین عنصر شامل این گروه غیرفلز کاربن میباشد. عناصر شامل این گروه کاربن(C)، سلیکان(Si)، جرمانیوم(Ge)، قلعی(Sn)، سرب(Pb) و فلوریوم (Fl) میباشند.
گروه ۱۵ یا پنجم اصلی (VA) بنام گروه نایتروجن (N2) یاد میگردد چون آغاز گروه با عنصر نایتروجن میباشد. عناصر شامل این گروه شامل برعلاوه نایتروجن(N)، فاسفورس(P)، ارسینیک(Ar)، انتیمونی(Sb)، بیسموت(Bi) و موسکویوم(Mc) میباشند.
گروه ۱۶ یا ششم اصلی (VIA) بنام گروه آکسیجن (O2) یاد میگردد. اولین عنصر شامل این گروه غیرفلز آکسیجن میباشد. این گروه بنام کلکوژنها نیز یاد میگردد، این نام از کلمات یونانی “کالکوس” (به معنی مس) و “ژن” (به معنی سازنده) گرفته شده است. دلیل این نامگذاری این است که بسیاری از عناصر این گروه در مواد معدنی مس یافت میشوند. در این گروه عناصر: آکسیجن(O)، سلفر(S)، سِلینیوم(Se)، تلوریوم(Te)، پولونیوم(Po) و لیوموریوم(Lv) شامل میشوند.
گروه ۱۷ یا هفتم اصلی (VIIA) بنام هلوجنها یاد میگردد. این گروه شامل عناصر فعال غیرفلز میباشند و ۵ عنصر شامل این گروه به حالت دو اتومی یا مالیکولی قرار دارند که شامل (F2, Cl2, Br2, I2, At2). کلمه هلوجن (Halogen) به معنی نمک ساز میباشد. غیرفلزات شامل این گروه به نسبت فعالیت زیاد کیمیاویشان با فلزات تعامل نموده و تشکیل نمکها را مینمایند. مانند: نمک طعام یا سودیم کلوراید(NaCl) که ترکیبی از دومین عنصر این گروه(Cl2) با فلز سودیم(Na) میباشد. همچنان با ترکیب آنها با آب تیزابها تشکیل میگردند.
 گروه ۱۸ یا هشتم اصلی (VIIIA) بنام گروه صفر و یا گازاتنجیب(Noble Gases) یاد میگردد. گازات شامل این گروه همه به شکل تک اتومی میباشند که شامل(He, Ne, Ar, Kr, Xe, Rn, Og) به لحاظ فعالیت کیمیاوی غیرفعال بوده از اینرو بنام گازاتنجیب یا بیاثر نیز یاد میگردند. دلیل اصلی برای فعالیت ضعیف بودن آنها در تعاملات کیمیاوی، تکمیل بودن سویهٔالکترونی آنها یا حالت اکتیت در آنها میباشد.
گروه ۱۸ یا هشتم اصلی (VIIIA) بنام گروه صفر و یا گازاتنجیب(Noble Gases) یاد میگردد. گازات شامل این گروه همه به شکل تک اتومی میباشند که شامل(He, Ne, Ar, Kr, Xe, Rn, Og) به لحاظ فعالیت کیمیاوی غیرفعال بوده از اینرو بنام گازاتنجیب یا بیاثر نیز یاد میگردند. دلیل اصلی برای فعالیت ضعیف بودن آنها در تعاملات کیمیاوی، تکمیل بودن سویهٔالکترونی آنها یا حالت اکتیت در آنها میباشد.
در بین گروه اصلی تعداد از عناصر وجود دارند که بنام شبهفلزات یاد میشوند. عناصر شبهفلزات در جدول ذیل نشان داده شدهاند.
گروههای فرعی (Transition metals):
این عناصر شامل گروههای 3 تا 12میباشند. گروههای فرعی را با حرف (B) بیان میکنند، که شامل(IB, IIB, IIIB, IVB, VB, VIB, VIIB, VIIIB) میباشند. این گروهها عناصری را دربر میگیرند که لایه d آنها در حال پر شدن است. همچنین، لنتانیدها و اکتینایدها نیز جزو گروههای فرعی محسوب میشوند.
 قرار ذیل به تشریح تعدادی از مشخصات مرتبط با عناصر شامل گروههای فرعی یا انتقالی میپردازیم:
قرار ذیل به تشریح تعدادی از مشخصات مرتبط با عناصر شامل گروههای فرعی یا انتقالی میپردازیم:
- عناصر شامل گروههای فرعی بنام گروههای واسط یاد میگردد، دلیل آن قرار گرفتن این عناصر در بین گروههای اصلی دوم(IIA) و سوم(IIIA) میباشد.
- موجودیت الکترونهای ولانسی در سویهٔ فرعی (d) در فلزات واسط، امکان تشکیل روابط کیمیاوی ضعیف و قوی با سایر عناصر و یا مالیکولها را فراهم میسازد.
- تمامی عناصر شامل این گروهها فلزات میباشند و خصوصیات مشترک فلزی دارند.
- این عناصر بنام عناصرانتقالی یاد میگردند. دلیل آن اشتراک این عناصر با ولانسهای مختلف در تعاملات کیمیاوی میباشند و قادر اند تا بر علاوهٔ الکترونهای قشر ولانسی آخرشان از سویههای پایینتر الکترونی نیز الکترون از دست بدهند و یا بگیرند. طور مثال: فلز آهن میتواند با نمبرهای اکسیدیشن (+۲) و (+۳) در تعاملات کیمیاوی اشتراک نماید و با آکسیجن دو نوع اکساید را تشکیل دهد. فیرساکساید (FeO) با نمبراکسیدیشن (+2) و فریکاکساید (Fe2O3) با نمبر اکسیدیشن (+3).
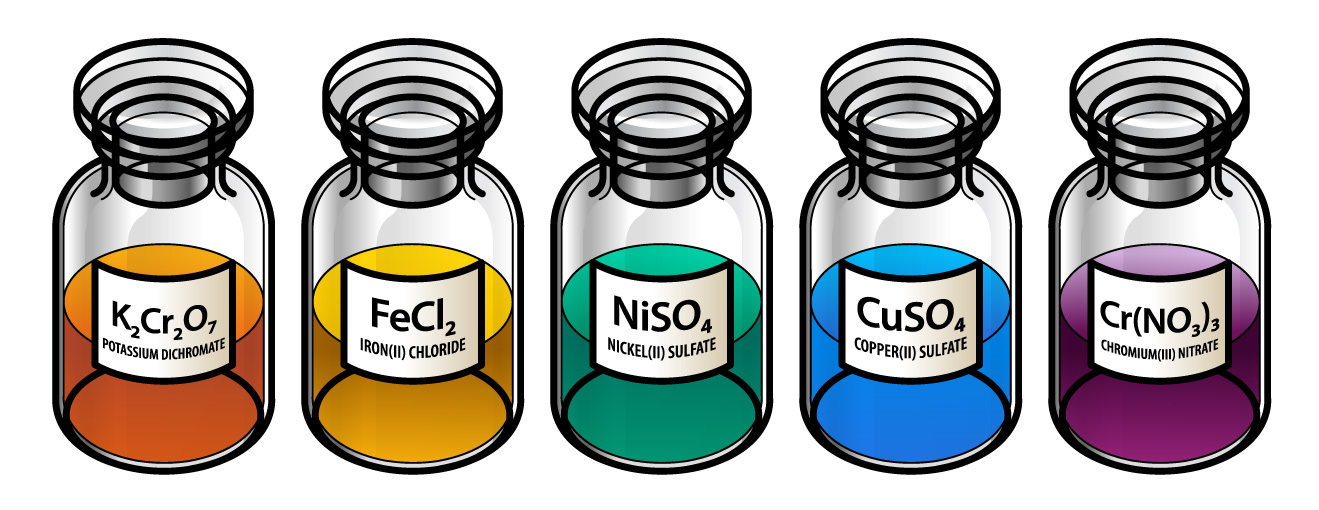
- این عناصر بیشتر مرکبات رنگه را تشکیل میدهند. اکسایدها و نمکهایشان رنگه هستند. طور مثال: نمک پوتاشویم کرومات (K₂CrO₄) رنگ زرد، اکساید فلز کروم(Cr₂O₃) سبز، سلفیت مس(CuSO₄) آبی، پرمنگانت پوتاشیوم (KMnO₄) بنفش میباشند.
- تعدادی از فلزات شامل گروههای فرعی در تعاملات کیمیاوی نقش تسهیل کننده تعاملات را داشته و به عنوان کتالیزهای استفاده میشوند. طور مثال: فلز پلاتین(Pt) و نیکل(Ni) در تعاملات عضوی عملیهٔ هایدروجنیشن (نصب هایدورجن) نقش اساسی دارند.
- فلزات گروههای فرعی تشکیل مرکبات مغلق يا كمپلکسها را مینمایند. مانند: تترا آمین مس (II) سلفات ([Cu(NH₃)₄]SO₄)، از این مرکب برای تشخیص آیونهای مس استفاده میشود و یک محلول آبی رنگ را تشکیل میدهد. همچنان فلز آهن که در تشکیل هیموگوبین خون در مرکز مالیکول با مالیکول آکسیجن تشکیل کمپلکس را مینماید.
دستهبندی گروههای فرعی در جدولتناوبیعناصر
در جدول تناوبی عناصر، گروههای فرعی به دو دسته اصلی تقسیم میشوند: عناصرانتقالی خارجی (فلزات واسط) و عناصر انتقالی داخلی (لنتانیدها و اکتینایدها). تفاوتهای کلیدی بین این دو دسته قرار ذیل میتواند توضیح گردد:
- موقعیت در جدول: عناصر انتقالی خارجی در وسط جدول تناوبی قرار دارند و شامل گروههای 3 تا 12 میشوند، اما عناصر انتقالی داخلی در دو ردیف جداگانه در پایین جدول تناوبی قرار دارند.
- نحوه پر شدن اوربیتالها در تقسمیات الکترونی: در عناصر انتقالی خارجی، اوربیتالهای d سویهٔ فرعیشان در حال پر شدن هستند. برای عناصر انتقالی داخلی مورد قابل توجه هستند، در لنتانایدها اوربیتالهای f سویه فرعی 4f درحال پر شدن هستند اما در اکتینایدها اوربیتالهای f سویه فرعی 5f در حال پر شدن میباشند.
- برای عناصر انتقالی خارجی میتوان موارد چون: ولانسهای متحول، تشکیل مرکبات رنگه و استفاده از آنها به عنوان کتالیز را درنظر گرفت.
- فلزات انتقالی خارجی به دلیل ویژگیهای منحصر بهفرد خود، کاربردهای گستردهای در صنایع مختلف دارند. به عنوان مثال، از آهن، مس، و المونیوم در ساخت و ساز، از طلا و نقره در جواهرسازی، و از پلاتین و پلادیوم در کتالیزورها استفاده میشود.
- برای عناصر انتقالی داخلی خواص کیمیاوی بسیار مشابه و رادیو اکتیف بودن عناصر یک شاخصه متمایز از عناصر انتقالی خارجی میباشد.
جدول ذیل نشان دهنده موقعیت سلسله لنتانایدها و اکتینایدها در جدول تناوبی عناصر میباشد.
 لنتانایدها و اکتینایدها، به عنوان عناصر انتقالی داخلی، کاربردهای گستردهای در صنایع مختلف دارند. در اینجا به برخی از مهمترین کاربردهای آنها اشاره میکنیم:
لنتانایدها و اکتینایدها، به عنوان عناصر انتقالی داخلی، کاربردهای گستردهای در صنایع مختلف دارند. در اینجا به برخی از مهمترین کاربردهای آنها اشاره میکنیم:
کاربردهای لنتانایدها:
- ساخت مقناطیس : نئودیمیوم (Nd) و سماریوم (Sm) در ساخت مقناطیسهای دایمی بسیار قوی استفاده میشوند که در موتورهای الکتریکی، جنراتورهای بادی، و هارد دیسکهای کمپیوتر کاربرد دارند.
- کتالیزورها: سیریم (Ce) به عنوان کتالیزور در مبدلهای کتالیزوری موترها برای کاهش آلایندههای هوا استفاده میشود.
- شیشهسازی و سرامیک: لنتانیوم (La) و سیریم (Ce) در تولید شیشههای ویژه با خواص نوری و حرارتی منحصر بهفرد کاربرد دارند. این عناصر در صنایع شیشه سازی، سرامیک سازی و تولید رنگ کاربرد دارند.
- ساخت لیزر: نئودیمیوم (Nd) در لیزرهای حالت جامد استفاده میشود.
- لامپهای فلورسنت: ییتریم(Y) و یوروپیوم(Eu) در لامپهای فلورسنت به عنوان فسفر استفاده میشوند.
- صنایع الکترونیک: گادولینیم(Gd) در فناوری تصویربرداری MRI کاربرد دارد.
کاربرد اکتینایدها:
- سوخت هستهای: یورانیوم (U) و پلوتونیوم (Pu) به عنوان سوخت در نیروگاههای هستهای استفاده میشوند.
- سلاحهای هستهای: پلوتونیوم (Pu) در ساخت سلاحهای هستهای کاربرد دارد.
- تداوی هستهای: امریکیوم (Am) در دستگاههای سنجش کثافت استخوان استفاده میشود.
- تحقیقات علمی: بسیاری از اکتینایدها در تحقیقات علمی، به ویژه در زمینه فیزیک هستهای، کاربرد دارند.
در این ویدیو نیز به تشریح ساختار فیزیکی جدول، اساس طبقه بندی عناصر و تشریح گروهها و دورهها پرداخته شده است.