پیشبینی خواص عناصر با شناحت جدول دورانی
آشنایی درست با جدول تناوبی عناصر به ما کمک میکند تا خصوصیات زیادی از عناصر را پیشبین داشته باشیم. در ادامه به تشریح مواردی میپردازیم که با شناخت درست از جدول دورانی، میتوانیم آنرا برای عناصر پیشبین باشیم.
- ساختار الکترونی عناصر
- خاصیت فلزی و غیرفلزی
- شعاعاتومی
- خاصیت الکترونیگاتیویتی
- خاصیت الکتروپوزیتف
- خواص الکترونخواهی
- انرژی آیونایزیشن
دستهبندی جدول دورانی براساس ساختار الکترونی عناصر
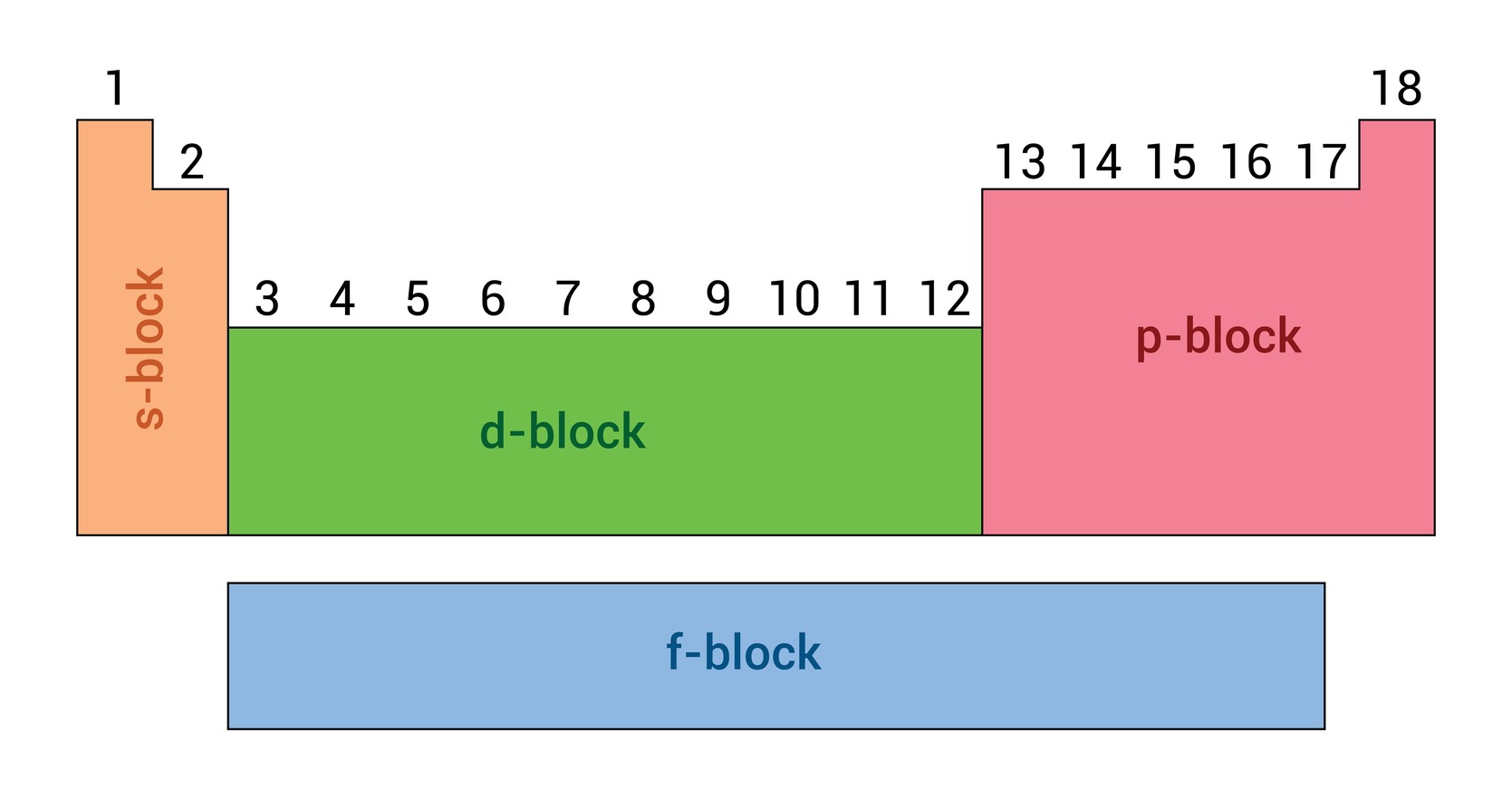
جدول تناوبی عناصر براساس آرایش الکترونی عناصر به طور مشخص قرار گرفتن الکترونهای ولانسی در سویههای فرعی یا اربیتالها به چهار بلاک (f,d,p,s) دستهبندی شده است. به عبارت دیگر هر بلاک نشان دهنده این است که آخرین الکترون یک عنصر در کدام نوع اربیتال قرار میگیرد. حروف (f,d,p,s) از نام اربیتالها گرفته شدهاند. دستهبندی عناصر به بلاکها ما را در شناسایی خواص فیزیکی و کیمیاوی عناصر کمک میکند.
در اینجا به توضیح خلاصه در مورد هر بلاک جدول تناوبی میپردازیم:
- بلاک (s): عناصر گروههای اول اصلی (IA) و دوم اصلی(IIA) شامل این بلاک میشوند. در این عناصرآخرین الکترون در اربیتال (s) آنها قرار میگیرد. در کل عناصر شامل این بلاک به لحاظ فعالیت کیمیاوی در تعاملات، فعال میباشند. (عناصر هایدروجن و هلیوم نیز شامل این بلاک هستند).
- بلاک (p): این بلاک شامل عناصر گروههای اصلی 13 الی 18 (VIIIA-IIIA) میباشد. در این عناصر با تقسیمات الکترونی، آخرین الکترون در اربیتال یا سویه فرعی (p) قرار میگیرد. این بلاک عناصر سه طیف مختلف از عناصر فلزی، غیرفلز و شبه فلز را شامل میشود.
- بلاک (d): این بلاک جدول شامل عناصر انتقالی خارجی میشود که عناصر گروههای فرعی 3 الی 12 (VIIIB-IB) در آن قرار دارند. در این عناصر، آخرین الکترون در اوربیتال (d) قرار دارد. فلزات شامل این بلاک در کل نقط ذوب بالا داشته و سخت میباشند.
- بلاک (f): این بلاک شامل عناصر لنتانیدها و اکتینایدها است که در پایین جدول تناوبی قرار دارند. در این عناصر، آخرین الکترون در اوربیتال f قرار دارد. عناصر شامل این بلاک در مشابهت خواص کیمیاوی خیلی با هم نزدیک هستند.
در جدول ذیل قرارگرفتن تعداد آخرین الکترونهای اتومهای عناصر برای بلاکهای مختلف، نشان داده شده است.
 حروف (f,d,p,s) برای نامگذاری بلاکهای جدول و اربیتالها از کجا می آیند؟
حروف (f,d,p,s) برای نامگذاری بلاکهای جدول و اربیتالها از کجا می آیند؟
حرف (s): این حرف از کلمه “sharp” به معنای “تیز” گرفته شده است. خطوط طیفی مربوط به اوربیتالهای s بسیار تیز و مشخص هستند.
حرف (p): این حرف از کلمه “principal” به معنای “اصلی” گرفته شده است. خطوط طیفی مربوط به اوربیتالهای p قوی و برجسته هستند.
حرف (d): این حرف از کلمه “diffuse” به معنای “پخششده” گرفته شده است. خطوط طیفی مربوط به اوربیتالهای d پخششده و محو هستند.
حرف (f): این حرف از کلمه “fundamental” به معنای “اساسی” گرفته شده است. خطوط طیفی مربوط به اوربیتالهای f پیچیده و اساسی هستند.
خاصیت فلزی و غیرفلزی
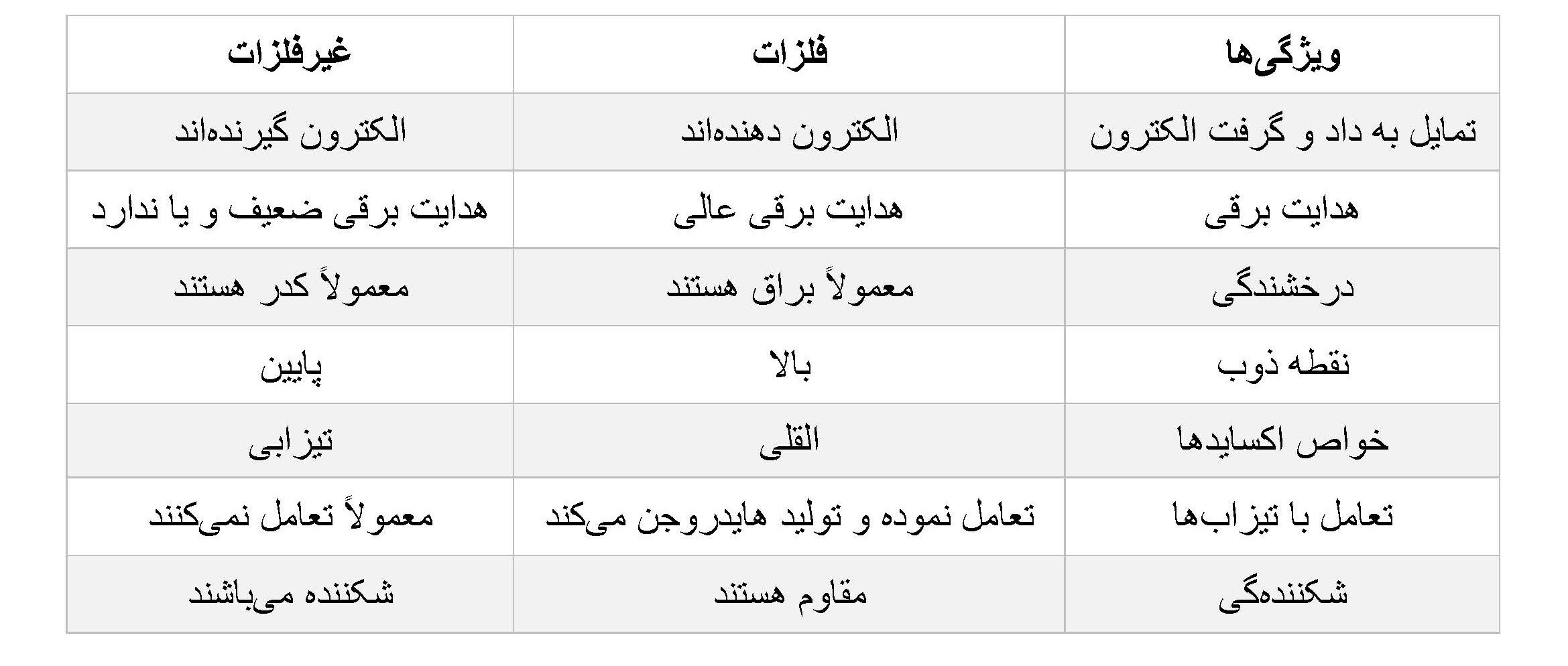
خاصیت فلزی و غیرفلزی دو ویژگی مهم عناصر در جدول تناوبی هستند که تفاوتهای اساسی در رفتار کیمیاوی و فیزیکی آنها ایجاد میکنند.
در جدول ذیل به مقایسه بعضی ویژه گیهای عناصر فلزی و غیرفلزی پرداخته شده و در ادامه تغییرات خاصیت فلزی و غیرفلزی در جدول نمایش داده شده است.
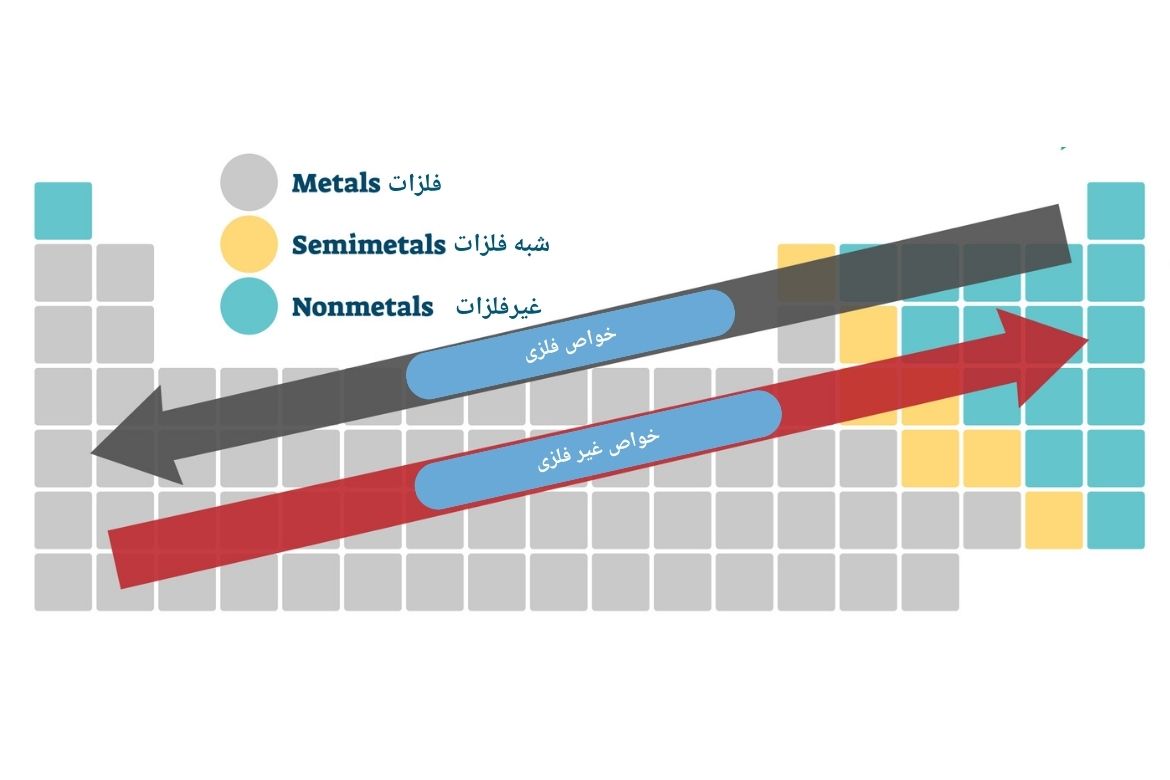
 در جدول تناوبی عناصر خواص فلزی و غیرفلزی قرار زیر قابل پیشبینی میباشند:
در جدول تناوبی عناصر خواص فلزی و غیرفلزی قرار زیر قابل پیشبینی میباشند:
به صورت خلاصه:
خاصیت فلزی: در هر تناوب از چپ به راست، خاصیت فلزی کاهش پیدا میکند و در هر گروه از بالا به پایین، خاصیت فلزی افزایش مییابد.
خاصیت غیرفلزی: در هر تناوب از چپ به راست افزایش مییابد و در هرگروه از پایین به بالا افزایش مییابد
شعاعاتومی (Atomic Radius)
شعاعاتومی یک خاصیت مهم برای هر عنصر میباشد که براساس آن میتوان تعدادی از خصوصیات کیمیاوی (تعامل پذیری) و خواص فیزیکی (نقطه جوش و کثافت) را پیشبین بود.
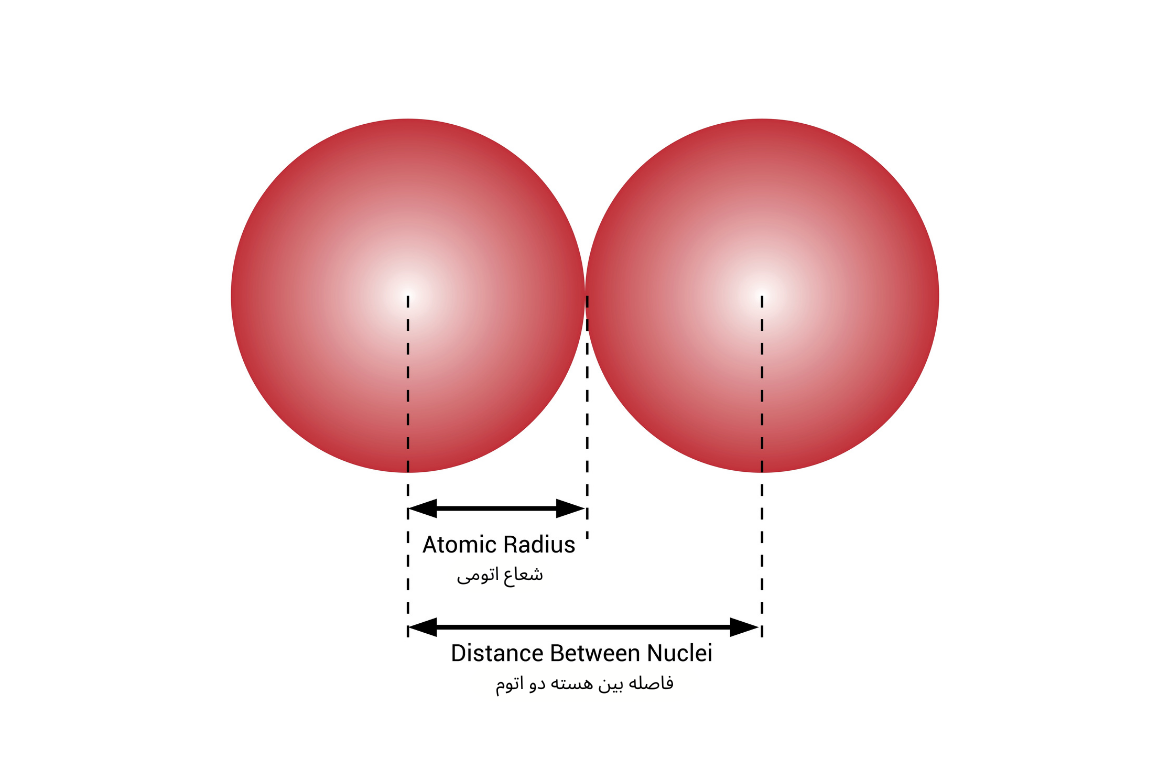
شعاعاتومی فاصله بین هسته یک اتوم و آخرین سویهٔ الکترونی آن تعریف میشود. همچنان نیم فاصله بین هسته دو اتوم همجوار را میتوان شعاعاتومی نامید.
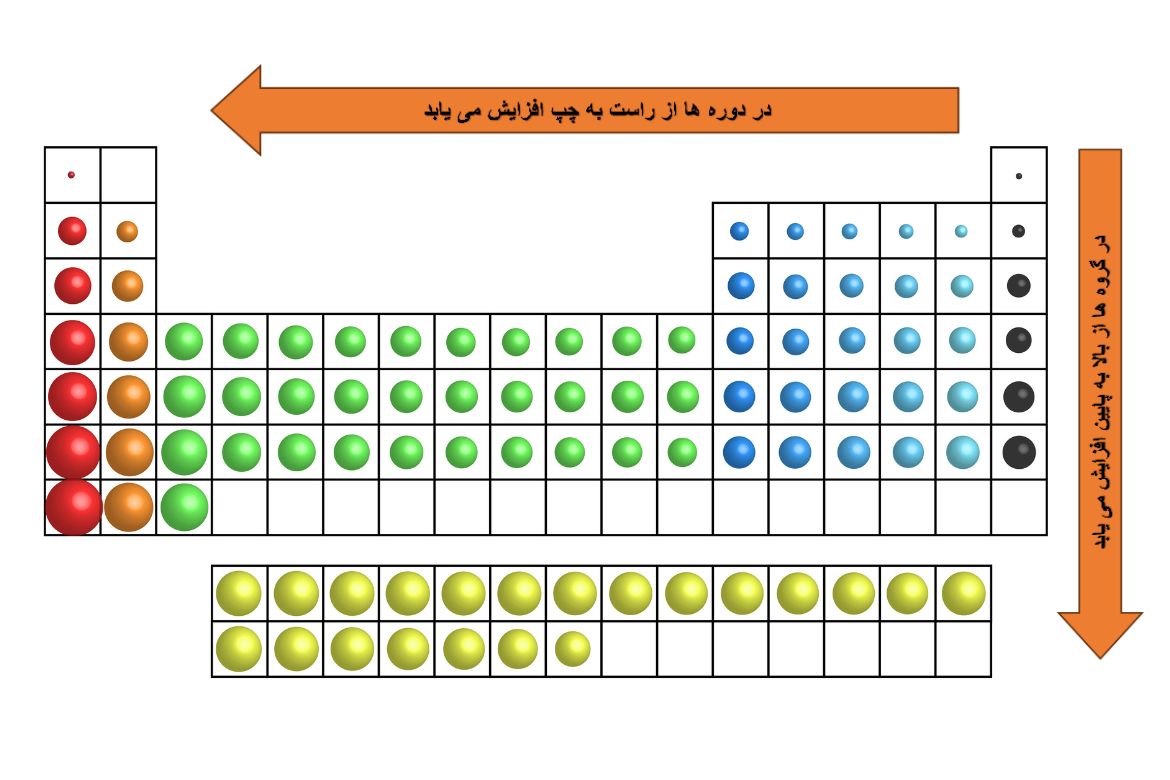
تغییرات در شعاعاتومی نظر به موقعیت عناصر در جدول تناوبی، قرار ذیل میباشد.
به صورت خلاصه:
شعاعاتومی: در طول یک گروه یا دسته از بالا به پایین، شعاعاتومی افزایش مییابد. دلیل این امر افزایش تعداد قشرها یا سویههای الکترونی است. با افزایش تعداد سویههای الکترونی، الکترونهای بیرونی، از هسته دورتر میشوند و در نتیجه، شعاعاتومی افزایش مییابد.
شعاعاتومی: در طول یک دوره یا پریود از چپ به راست، شعاعاتومی کاهش مییابد. دلیل این امر افزایش چارچ هسته یا تعداد پروتونها در هسته اتومها میباشند. با افزایش تعداد پروتونها در هسته، قوه جاذبه بین هسته و الکترونها افزایش مییابد و در نتیجه، الکترونها به هسته نزدیکتر میشوند.
خاصیت الکترونیگاتیویتی و الکتروپازیتیویتی
دو خاصیت الکترونیگاتیویتی و الکتروپازیتیویتی به رفتار اتومهای عناصر در تشکیل روابط کیمیاوی مربوط میشوند که قرار ذیل به تشریح آنها و تغییرات آن در جدول دورانی عناصر میپردازیم.
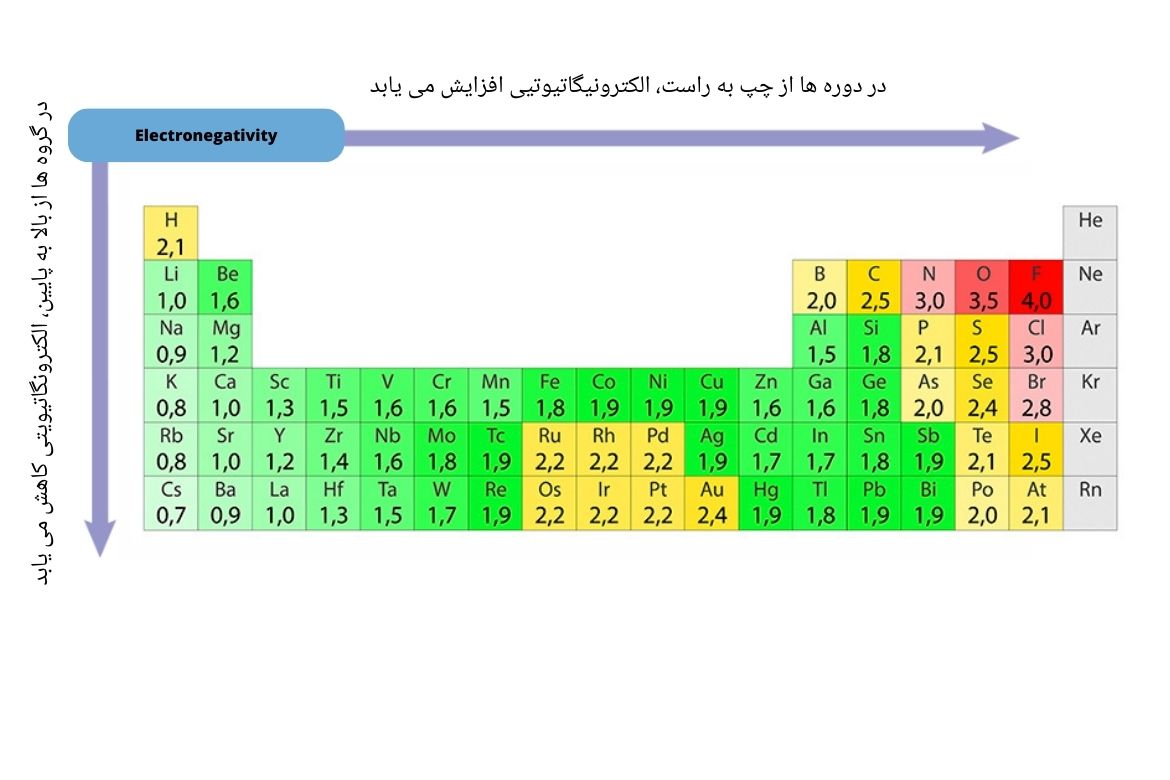
الکترونگاتیویتی (Electronegativity): به معیاری تمایل یک اتوم برای تشکیل روابط کیمیاوی گفته میشود. به عبارت دیگر نشان دهنده این است که یک اتوم تا چه حد میتواند الکترون را به سوی خود بکشد. در بین عناصر جدول غیرفلز فلورین بیشترین قدرت جذب الکترون را داشته و الکترونیگاتیوتیی 4 را دارا میباشد. در مقابل فلزاتالقلی شامل گروه اول دارای کمترین الکترونیگاتیویتی میباشند. برای عناصر الکترون گیرنده، الکترونیگاتیف گفته میشود.
خاصیت الکترونیگاتیویتی در جدول دورانی عناصر قرار ذیل میتواند قابل پیشبینی باشد:
- در دورهها با افزایش چارچ هسته از چپ به راست، افزایش مییابد. چنانچه عنصر فلورین در گروه هفتم طرف راست جدول بزرگترین الکترونیگاتیویتی را دارد.
- در گروهها با افزایش چارچ هسته، از بالا به پایین، کاهش مییابد. چنانچه فلز فرانسیوم (Fr) در ختم گروه اول اصلی(IA) کمترین الکترونیگاتیویتی (79) را دارد.
الکتروپازیتیویتی (Electropositivity): این خاصیت برعکس الکترونیگاتیویتی عمل میکند. تمایل از دست دادن الکترونها توسط یک اتوم را الکتروپازیتیویتی میگویند. برای عناصر الکترون دهنده، الکتروپازیتیف گفته میشوند. دربین عناصر، فلزات از خاصیت الکتروپازیتیف بالا برخورداراند و این خاصیت به عنوان یک مشخصه مهم برای فلزات شناخته میشود.
خاصیت الکتروپازیتیویتی در جدول دورانی عناصر قرار زیر میتواند قابل پیشبینی باشد:
- در دورهها با افزایش چارچ هسته در اتومها، از چپ به راست کاهش مییابد. چنانچه فلزات گروه اول اصلی، الکتروپازیتیف ترین عناصر و غیرفلزات شامل گروه هفتم اصلی از جمله ضعیفترین الکتروپازیتیفها اند.
- در گروهها با افزایش قشرهای الکترونی از بالا به پایین، افزایش مییابد.
جدول ذیل تغییرات در خواص الکترونیگاتیویتی را در طول پریودها و گروهها نشان می دهد.
قبلا ذکر شد که این دو خاصیت متضاد یکدیگر هستند، یعنی یک اتوم نمیتواند همزمان هم الکترونیگاتیف قوی و هم الکتروپازیتیف قوی باشد.
با دانستن تفاوت الکترونیگاتیویتی بین دو اتوم، میتوانیم نوعیت رابطه کیمیاوی بین آنها را پیشبین باشیم:
- اگر تفاوت الکترونگاتیویتی زیاد باشد، رابطه برقی یا آیونی تشکیل میشود.
- اگر تفاوت الکترونگاتیویتی متوسط باشد، رابطه اشتراکی قطبی تشکیل میشود.
- اگر تفاوت الکترونگاتیویتی کم باشد، رابط اشتراکی یا کولانسی غیرقطبی تشکیل میشود.
برای گازات نجیب چون قشرهای الکترونی آنها به صورت کامل پرشده میباشند، از اینرو این عناصر تمایل به تشکیل روابط کیمیاوی نداشته و عدد الکترونیگاتیویتی برای آنها پیشنهاد نشده است. همچنان سلسله لنتانایدها و اکتینایدها که خواص پیچیده کیمیاوی را از خود نشان میدهند، از روند خاص برای تعیین اندازه الکترونیگاتیویتی پیروی نمیکنند.
انرژی آیونایزیشن (Ionization Energy)
اتومها برای جدا کردن الکترونها در حالت گازی، نیاز به انرژی دارند. به انرژی مورد نیاز برای جدا کردن الکترون از یک اتوم خنثی در حالت گازی، انرژی آیونایزیشن میگویند. این انرژی برای اتومها، مفهوم متضاد با الکترونیگاتیویتی دارد. هرقدر انرژی آیونایزیشن یک اتوم کم باشد، به راحتی الکترون باخته و به کتیون (آیون با چارچ مثبت) تبدیل میشود.
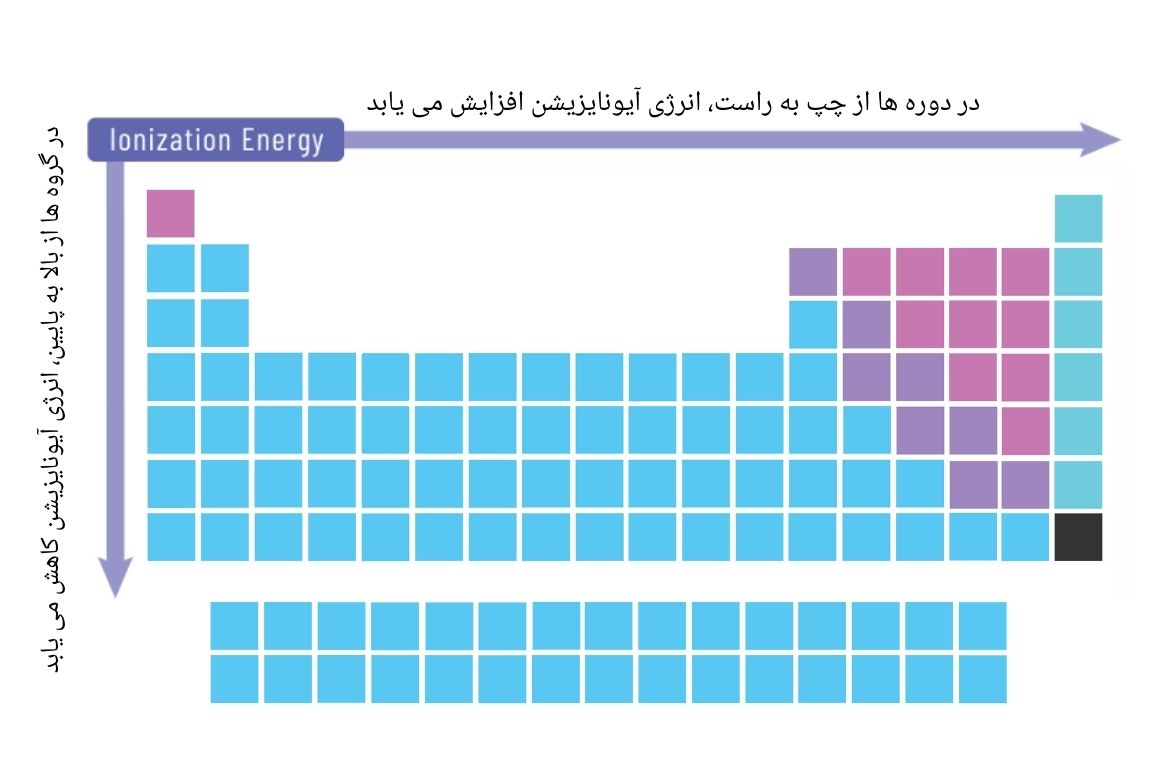
تغییرات در انرژی آیونایزیشن اتومهای عناصر در جدول تناوبی را قرار ذیل میتوان پیشبینی کرد.
به صورت خلاصه تغییرات انرژی در جدول تناوبی، قرار ذیل میباشد:
- در دورهها با افزایش نمبراتومی (چارچ هسته) که سبب مستحکم نگهداشتن الکترونها در اطراف هسته اتوم میگردد، از چپ به راست، انرژی آیونایزیشن افزایش مییابد.
- در گروهها از بالا به پایین به دلیل افزایش تعداد قشرهای الکترونی که سبب دور نگهداشتن الکترون از تاثیر هسته میگردد، انرژی آیونایزیشن، کاهش مییابد.
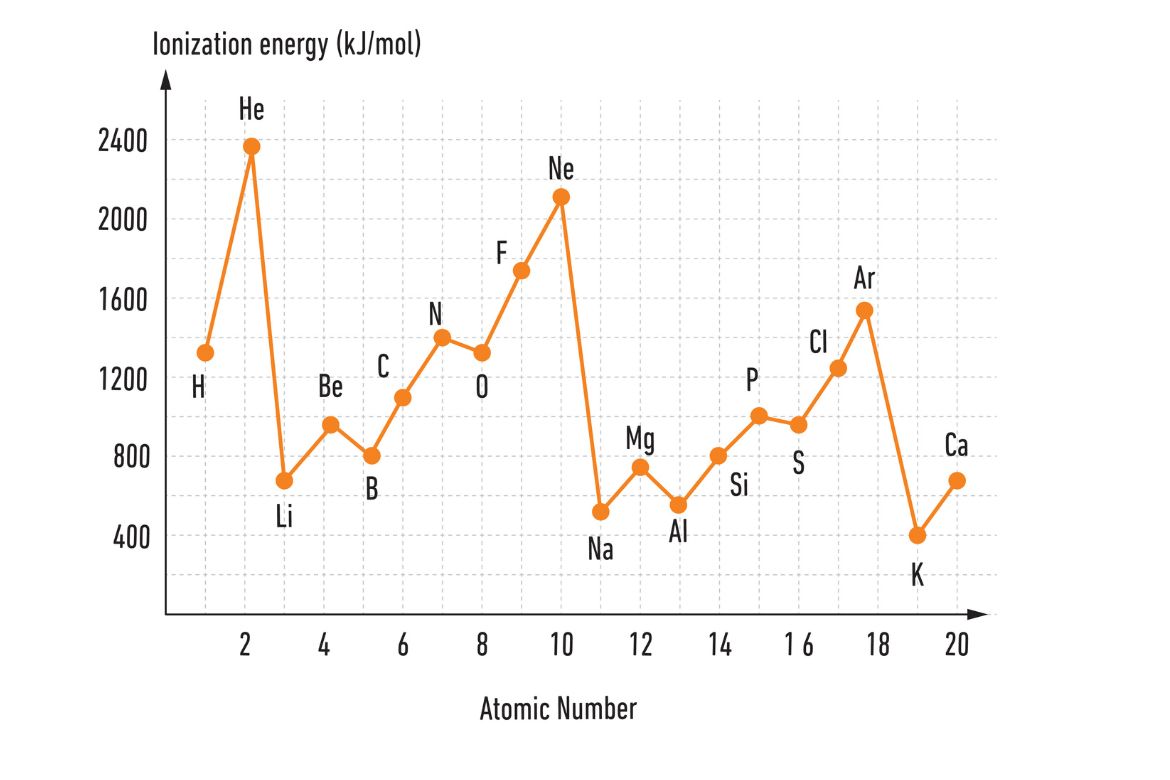
- گازهای نجیب، به دلیل ظرفیت تکمیل شده مدارهای الکترونیشان، انرژی آیونایزیشن بسیار بالایی دارند. در این میان، هلیوم بیشترین انرژی آیونایزیشن را در میان تمامی عناصر دارا است.
در جدول ذیل اندازه انرژی آیونایزیشن(به واحد کیلوژول)، با درنظرداشت نمبراتومی برای تعدادی از عناصر نمایش داده شده است.
الکترونخواهی(Electron Affinity)
الکترونخواهی طوری که از نام آن پیداست، به توانایی یک اتوم برای پذیرش یک الکترون میگویند. برخلاف الکترونگاتیویتی، الکترونخواهی، خاصیت کمی (Quantitative) و بیانگر تغییر انرژی به هنگام اضافه کردن یک الکترون به اتوم گازی خنثی است. هر قدر مقدار الکترونخواهی منفی باشد، تمایل یک اتوم به جذب الکترون بیشتر خواهد بود. به عبارت دیگر به مقدار انرژی آزاد شده در هنگام اضافه شدن الکترون به اتوم یا مالیکول خنثی گازی شکل و تشکیل آیون منفی، الکترونخواهی گفته میشود.
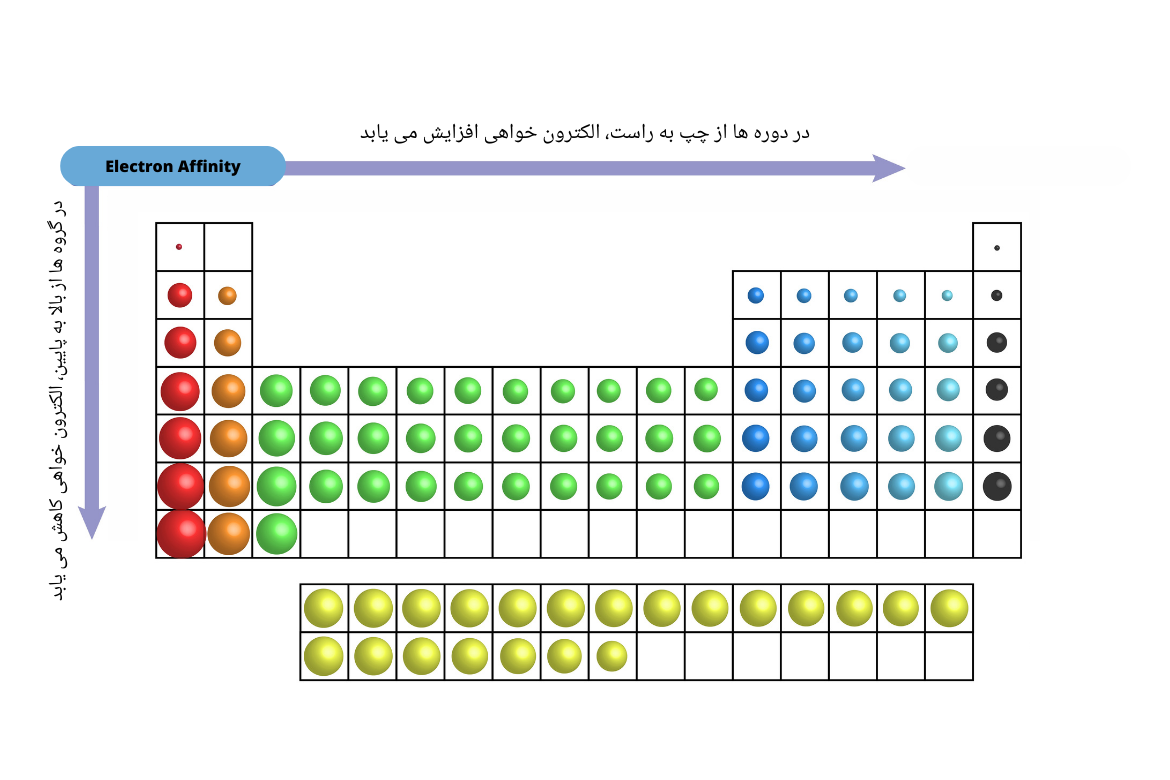 به صورت خلاصه خاصیت الکترونخواهی در عناصر را در جدول تناوبی قرار زیر میتوان پیشبینی کرد:
به صورت خلاصه خاصیت الکترونخواهی در عناصر را در جدول تناوبی قرار زیر میتوان پیشبینی کرد:
- در دورهها از چپ به راست، خاصیت الکترونخواهی در عناصر افزایش مییابد. دلیل آن افزایش چارچ هسته اتومهایی بوده که سبب میگردد، الکترونها را به آسانی جذب نمایند.
- درگروهها از بالا به پایین، این خاصیت کاهش مییابد. دلیل آن افزایش تعداد اقشار یا سویههای انرژی در اطراف هسته اتوم میباشد که سبب تاثیر کمتر چارچ هسته بالای الکترونها میگردد.
در میان غیرفلزات هلوجنها(عناصر گروپ هفتم اصلی)، الکترونخواهی بالایی را دارند. در بین فلزات، عناصر گروههای اول و دوم اصلی (فلزاتالقلی و القلیزمینی)، خاصیت الکترونخواهی ضعیف دارند.
گازات نجیب در بین تمامی عناصر، خواص الکترونخواهی خیلی ضعیف دارند چون مدار آخر الکترونی آنها تکمیل میباشد.