تاریخچهٔ طبقهبندی عناصر
آغاز طبقهبندی عناصر را میتوان با پیشرفتهای کیمیای تحلیلی در قرن نزدهم مرتبط دانست. در اوایل قرن نزدهم کیمیای تحلیلی به پیشرفتهای چشمگیری درمورد شناسایی خواص کیمیاوی و فیزیکی مواد دست یافت و این پیشرفت نیازمندی به طبقهبندی عناصر کشف شده در آن دوره را برای دانشمندان بیشتر ساخت. اولین طبقهبندی در سال 1817 توسط دوبرینر (J.W. Dobereiner) صورت گرفت. او نشان داد که کتلهاتومی استرانشیوم در بین کتلههای اتومی فلزات کلسیم و باریوم قرار میگیرد، او این طبقهبندی خود را سهگانه(Triads) نامید که بعداً سهگانههای دیگری چون(کلوین، بورون، آیودین) و (لیتویم، سدیم، پوتاشیوم) به طبقهبندی اضافه شدند. اما با اضافه شدن عنصر فلورین در بین هلوجنها، فلز مگنیزیم در بین عناصر القلی زمینی و همچنان قرار گرفتن عناصر آکسیجن، تلوریم، سلفر و سلینیوم در یک ردهبندی در ضمن با قرارگرفتن عناصر نایتروجن، فاسفورس، ارسنیک، بیسموت و انتیمونی در یک خانواده، بین سالهای 1827 الی 1858، دانشمندان به این نتیجه رسیدند که شباهتها بیشتر از آن است که دوبرینر گفته است و تلاشها برای طبقهبندی بیشتر شد.
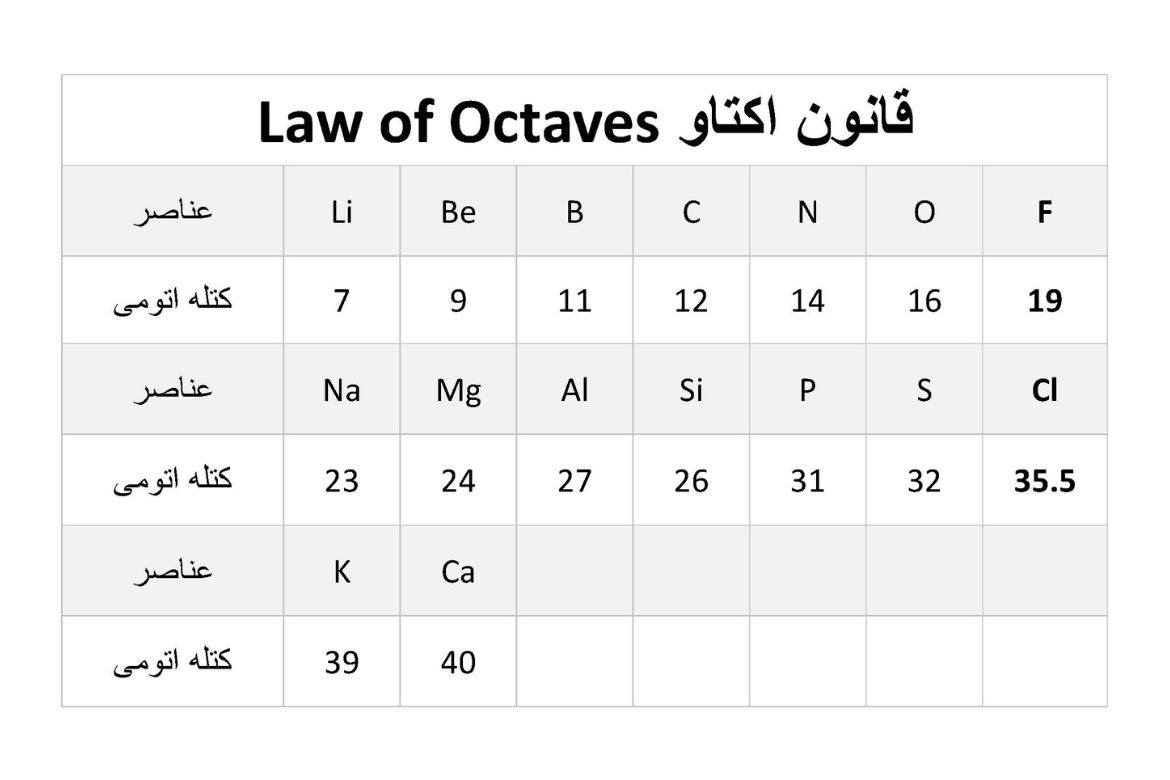
جان نیولندز (John Newlands) کیمیادان بریتانیوی در سال 1864، طبقهبندی عناصر براساس کتلهاتومی را ارائه کرد. عناصر براساس افزایش کتلههای اتومیشان به هفت گروه تقسیم شدند. عناصر شامل عین گروه دارای خواص مشابه با سرگروه خود داشتند. این قاعده تقسیم بندی بنام اکتاو(Law of Octaves) یاد میگردد چون خواص مشابه در عناصر بعد از هر هشت عنصر تکرار میشود. عناصری که در جدول نیولندز در آغاز هرگروه قرار گرفته بودند به ترتیب شامل: هایدروجن، لیتیوم، بریلیوم، بورن، نایتروجن و آکسیجن بودند. طورمثال با آغاز حساب از لیتیوم تا به هشت، به عنصر سودیم می رسیم که به لحاظ خواص با هم مشابه میباشند. اکتاو از تشابه اسمی فواصل هفتگانه در گامهای موسیقی گرفته شده بود.
طبقهبندی اکتاو توسط نیولندز در جدول ذیل نشان داده شده است.
 دیمتری مندلیف (Dmitri Mendeleev) کیمیادان روسی در سال 1869، قانون تناوب را پیشنهاد کرد. او خواص عناصر را با کتلهاتومی آنها مرتبط می دانست، براساس قاعده مندلیف عناصری که براساس ازدیاد کتلهاتومیشان ترتیب شدهاند، خواص مشابه را از خود نشان میدهند.
دیمتری مندلیف (Dmitri Mendeleev) کیمیادان روسی در سال 1869، قانون تناوب را پیشنهاد کرد. او خواص عناصر را با کتلهاتومی آنها مرتبط می دانست، براساس قاعده مندلیف عناصری که براساس ازدیاد کتلهاتومیشان ترتیب شدهاند، خواص مشابه را از خود نشان میدهند.
قابل ذکراست که لوتارمایر (Lothar Meyer) کیمیا – فیزیکدان آلمانی هم جداگانه این مطلب را بعد از مقاله مندلیف به چاپ رساند.
جدول ذیل نشان دهنده قانون مندلیف برای طبقهبندی عناصر میباشد.
 جدول مندلیف شامل 17 ستون بود. در جدول ترتیب شده توسط مندلیف دو دوره کامل وجود داشتند. یکی از دورهها با عنصر پوتاشیوم آغاز و به عنصر بورون ختم میشد و دوره دومی با روبیدیم آغاز و با آیودین ختم می گردید. دو ردیف متشکل از هفت، هفت عنصر بودند که شامل(لیتیوم تا فلورین) و (سودیم تا کلورین) میشدند. همچنان سه دوره یا ردیف به شکل ناتکمیل را شامل میشد. مندلیف در سال 1871 جدول ترتیبی خود را بازنویسی کرد و جای 17 عنصر را در آن تغییر داد. این بار او یک جدول متشکل از هشت ستون را ترتیب داد. ستونهای هشت تایی شامل هفت دوره یا ردیف میشدند و هر ردیف شامل هفت عنصر بود. در ستون هشتم جدول مندلیف سه فلز به عنوان عنصرمرکزی شامل میباشند که عبارت از عناصر: آهن، کوبالت و نیکل میباشند. مندلیف در اصلاح جدید خود عنصر مس را از گروه اول به گروه هشتم انتقال داد.
جدول مندلیف شامل 17 ستون بود. در جدول ترتیب شده توسط مندلیف دو دوره کامل وجود داشتند. یکی از دورهها با عنصر پوتاشیوم آغاز و به عنصر بورون ختم میشد و دوره دومی با روبیدیم آغاز و با آیودین ختم می گردید. دو ردیف متشکل از هفت، هفت عنصر بودند که شامل(لیتیوم تا فلورین) و (سودیم تا کلورین) میشدند. همچنان سه دوره یا ردیف به شکل ناتکمیل را شامل میشد. مندلیف در سال 1871 جدول ترتیبی خود را بازنویسی کرد و جای 17 عنصر را در آن تغییر داد. این بار او یک جدول متشکل از هشت ستون را ترتیب داد. ستونهای هشت تایی شامل هفت دوره یا ردیف میشدند و هر ردیف شامل هفت عنصر بود. در ستون هشتم جدول مندلیف سه فلز به عنوان عنصرمرکزی شامل میباشند که عبارت از عناصر: آهن، کوبالت و نیکل میباشند. مندلیف در اصلاح جدید خود عنصر مس را از گروه اول به گروه هشتم انتقال داد.
مجسمه مندلیف و نقش برجستهای که شاهکاری او برای جدول تناوبی عناصر کیمیاوی را به تصویر میکشد.
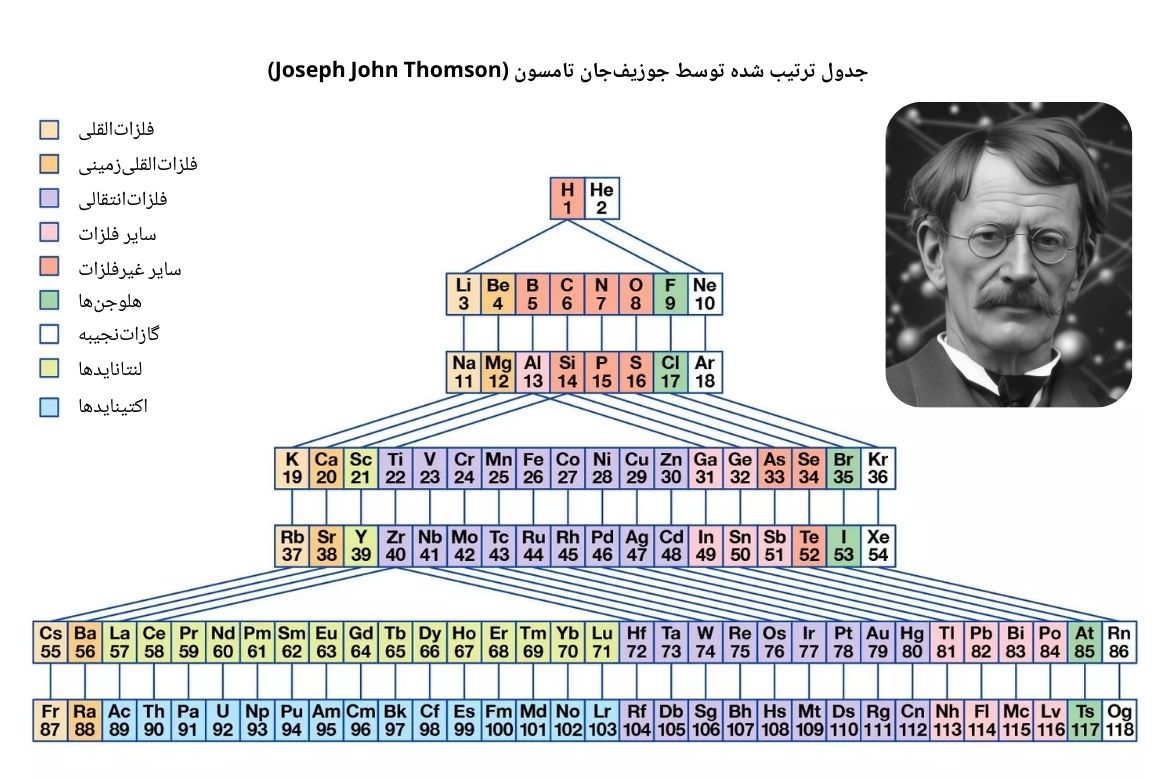
 جوزیف جان تامسون(Joseph John Thomson) فیزیکدان انگلیسی در سال 1895 مودل جدیدی برای جدول ارائه نمود. جدول تامسن شامل دورههای بود که به ترتیب طول آنها افزایش مییافتند. تناوبهای جدول شامل دو عنصر، هشت عنصر، هجده عنصر و سی ودو عنصر میشدند.
جوزیف جان تامسون(Joseph John Thomson) فیزیکدان انگلیسی در سال 1895 مودل جدیدی برای جدول ارائه نمود. جدول تامسن شامل دورههای بود که به ترتیب طول آنها افزایش مییافتند. تناوبهای جدول شامل دو عنصر، هشت عنصر، هجده عنصر و سی ودو عنصر میشدند.
در جدول ترتیب شده توسط تامسون، عناصر شامل یک دوره توسط خطوط مستقیم با عناصری که در دورههای دیگر به لحاظ خواص کیمیاوی باهم شباهت داشتند، ارتباط داده میشدند که این موضوع سبب میشد تا جدول کمی پیچیده شود. همچنان قرار گرفتن 32 عنصر در عین دوره و مرتبط ساختن آنها با عناصر سایر دورهها که به لحاظ خواص باهم مشابه بودند، کار را بیشتر جنجالی میساخت. در جدول ارائه شده تامسون، لنتانایدها و اکتینایدها با عناصر انتقالی داخلی یکجا قرار گرفته بودند. عناصر انتقالی داخلی و عناصر انتقالی خارجی در ادامه بحث میشوند.
 تغییرات در جدول با کشف عناصر بیشتر
تغییرات در جدول با کشف عناصر بیشتر
با کشف عناصر بیشتر مخصوصاً گازات نجیبه، مندلیف و سایر دانشمندان برای انکشاف جدولهای ترتیب شدهای قبلی تلاش نمودند. با کشف گازات نجیب، گروه صفر در جدول مندلیف اضافه گردید. جدول شامل گازات نجیب تا سال 1930 مورد استفاده قرار میگرفت. جدول ارائه شده با جدول مندلیف تفاوت کمی داشت.
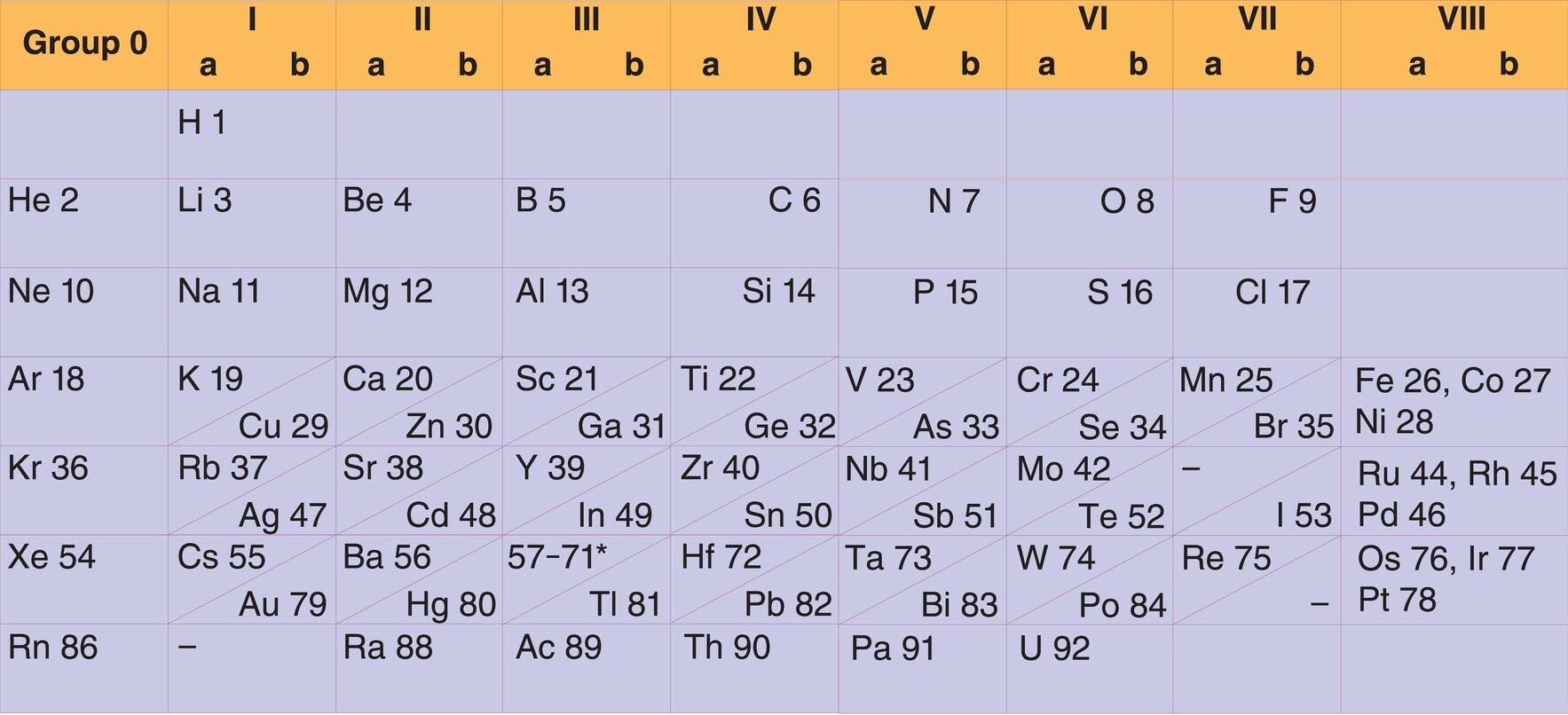 ارزش بالای قانون تناوب زمانی مشخص شد که مندلیف متوجه گردید، خواص مشابه در بین 17 عناصر با عناصر دیگر مرتبط میباشد. او این کار را با انتقال 17 عنصر در جدول و ترتیب آنها براساس ازدیاد کتلهاتومی انجام داد. این تغییر توسط مندلیف نشان داد که خطای کمی در اندازهگیری کتلهاتومی عناصر وجود دارد. همچنان با این تغییر او متوجه خطاهای بزرگ در اندازهگیری کتلههای اتومی تعدادی از عناصر شد. با وجود تلاش برای اصلاح در اندازهگیری کتلههای اتومی عناصر، تعداد از عناصر در جدول ترتیب شده توسط مندلیف و لوترمایر باید براساس مفهومی غیر از کتلهاتومی تنظیم میشدند. مشکلات قابل مشاهده در جدول مندلیف را میتوان برای جوره عناصر چون ارگون – پوتاشیوم، کوبالت – نیکل و تلوریم – آیودین مثال داد که عناصر قبلی کتلهاتومی بیشتری نسبت به بعد از خود دارند. این مشکل با فهم بیشتر از ساختار اتوم به راهحل رسید.
ارزش بالای قانون تناوب زمانی مشخص شد که مندلیف متوجه گردید، خواص مشابه در بین 17 عناصر با عناصر دیگر مرتبط میباشد. او این کار را با انتقال 17 عنصر در جدول و ترتیب آنها براساس ازدیاد کتلهاتومی انجام داد. این تغییر توسط مندلیف نشان داد که خطای کمی در اندازهگیری کتلهاتومی عناصر وجود دارد. همچنان با این تغییر او متوجه خطاهای بزرگ در اندازهگیری کتلههای اتومی تعدادی از عناصر شد. با وجود تلاش برای اصلاح در اندازهگیری کتلههای اتومی عناصر، تعداد از عناصر در جدول ترتیب شده توسط مندلیف و لوترمایر باید براساس مفهومی غیر از کتلهاتومی تنظیم میشدند. مشکلات قابل مشاهده در جدول مندلیف را میتوان برای جوره عناصر چون ارگون – پوتاشیوم، کوبالت – نیکل و تلوریم – آیودین مثال داد که عناصر قبلی کتلهاتومی بیشتری نسبت به بعد از خود دارند. این مشکل با فهم بیشتر از ساختار اتوم به راهحل رسید.
تغییرات در جدول با کشف چارچ برقی و ایزوتوپها
ارنیست رادرفورد (Ernest Rutherford) فیزیکدان نیوزیلاندی در 1910، با آزمایش روی خاصیت پخش ذرات الفا توسط هسته اتومهای سنگین موفق شد تا چارچ برقی در هسته اتوم را کشف کند. نسبت چارچ هسته بر چارچ الکترون در حدود نصف کتلهاتومی ذکر شده است. در سال 1911 انتونیوس وان دِن بروک (Antonius van den Broek) دانشمند آلمانی چارچهای موجود در هستهٔ اتومها را بنام نمبراتومی یاد کرد و اولین شخصی بود که موقعیتهای مناسب برای عناصر در جدول دورانی را توانست تشخیص دهد.
این پیشنهاد در سال 1913، زمانیکه هنری موزلی (Henry Moseley) مشغول اندازهگیری طول موج طیف خطی اشعهٔ ایکس برای بسیاری از عناصر بود، اثبات شد. اندازهگیریهای موزلی نشان داد که طول موج اشعهٔ ایکس توسط هر عنصر به خوبی با نمبراتومی عناصر در جدول وابسته است. از اینجا بود که روش جدید و مناسب برای طبقهبندی عناصر براساس نمبراتومی توسط هنری موزلی پیشنهاد و عناصر به شکل امروزی طبقهبندی شدند.
دو مورد دیگری که سبب گردیدند تا قانون تناوب براساس کتلهاتومی را به چالش بکشند، معرفی ایزوتوپها و انکشاف در شناسایی ساختار اتوم بود.
عدم وابستگی محلهای انتخاب شده در جدول براساس کتلهاتومی، با معرفی ایزوتوپها بیان شد. ایزوتوپها به هستههای عین اتومهای گفته میشوند که به لحاظ چارچ برقی (تعداد پروتونها و الکترون ها) یکساناند اما در کتلهاتومی از هم فرق دارند. همچنان ایزوتوپهای عین عنصر به لحاظ خواص کیمیاوی با هم مشابهاند.
انکشاف در شناسایی بهتر ساختار الکترونی اتومها و تیوری کوانتوم که در سال 1913 توسط نیلزبور(Niels Bohr) آغاز شد، در فهم دقیقترقانون تناوب کمک کرد. همچنان اصل طرد پاولی (اصل طرد پاولی یا Pauli exclusion principle بیان میکند که هیچ دو الکترونی در یک اتم نمیتوانند هر چهار عدد کوانتومی یکسانی داشته باشند. به عبارت دیگر، حداقل یکی از این اعداد کوانتومی باید برای دو الکترون متفاوت باشد.) در سال 1925 و توسعه میخانیک کوانتوم توسط هایزنبرگ و شرویدینگر نیز گامهایی اند که در همان سال برداشته شد. همچنان توسعه تیوری ولانسی با تکیه بر مفهوم الکترون اشتراکی توسط لوییس در سال 1916 هم نقش بسیاری را در توسعه قانون تناوب داشت.

