د دوراني جدول معاصره طبقه بندي
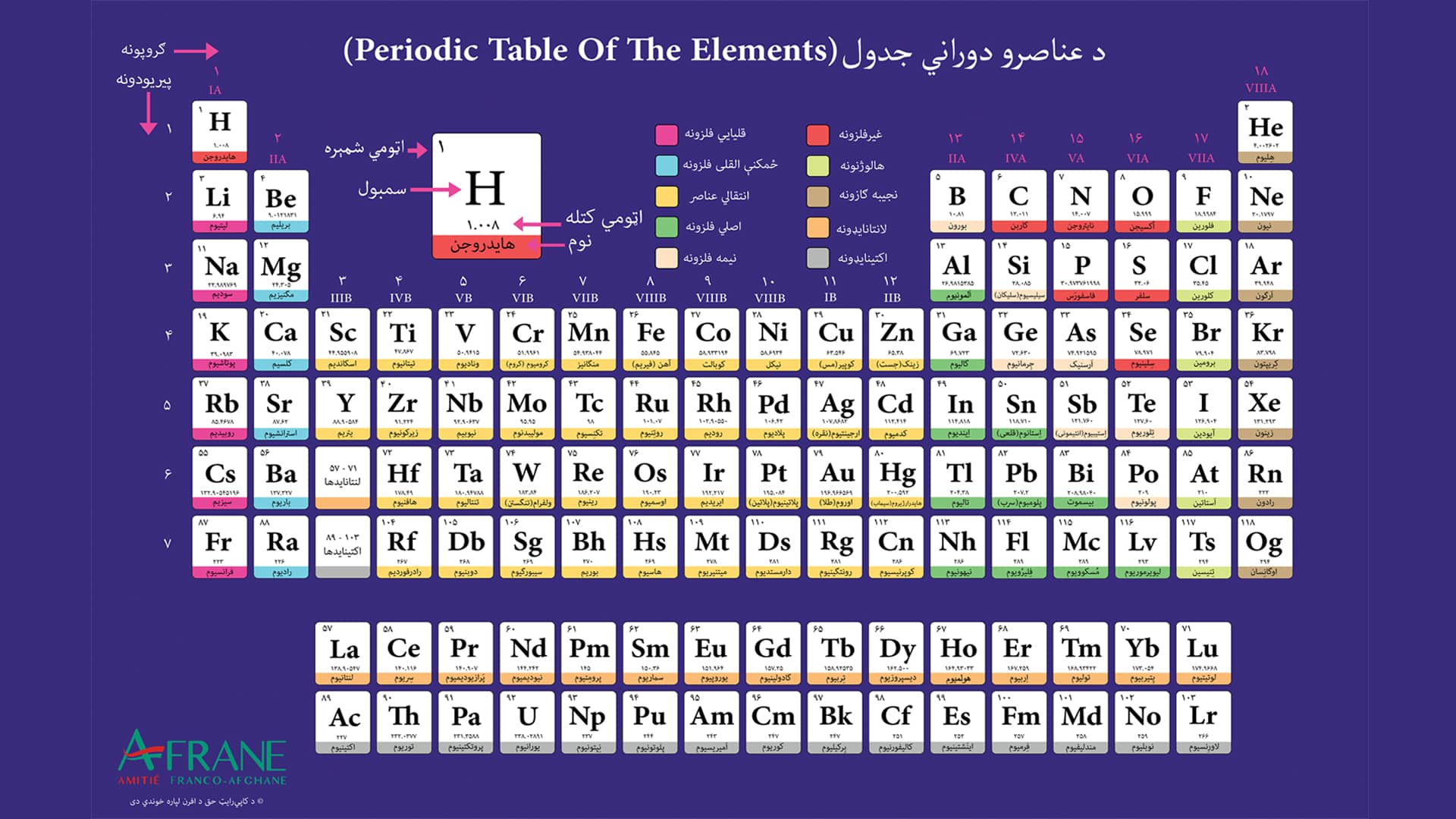
د عناصرو تناوبي جدول (Periodic table of elements)، چې د مندلیف جدول هم ورته ویل کیږي، عناصر د اتومي نمبر، الکتروني آرایش او کیمیاوي خواصو پر اساس طبقه بندي کوي. دا جدول د عناصرو د خواصو په ښه درک او د هغوی د چلند په وړاندوینه کې مرسته کوي.
دوراني جدول له ۱۸ ډلو (عمودي ستنو) او ۷ دورو (افقي لیکو) څخه جوړ شوی دی، چې په لاندې ډول به یې تشریح کړو.
په لاندې ډول تاسو کولی شئ د عناصرو نوی دوراني جدول په دري – فارسي ژبه کې وګورئ او ډاونلوډ یې کړئ.
په دوراني جدول کې تناوبونه (دورې)
د عناصرو دوراني جدول اووه دورې یا افقي قطارونه لري چې په لاندې ډول پر عناصرو بشپړې شوي دي:
- د جدول په لومړۍ دوره کې ۲ عناصر شامل دي: هایدروجن او هیلیوم.
- په دویمه دوره کې ۸ عناصر شامل دي، چې له لیتیم فلز څخه پیل کیږي او په نیون نجیب غاز پای ته رسیږي.
- په درېیمه دوره کې هم ۸ عناصر شامل دي، چې له سوډیم فلز څخه پیل کیږي او په ارګون نجیب غاز پای ته رسیږي.
- په څلورمه دوره کې ۱۸ عناصر شامل دي، چې له پوټاشیم عنصر څخه پیل کیږي او په کریپټون نجیب غاز پای ته رسیږي.
- په پنځمه دوره کې ۱۸ عناصر شامل دي، چې له روبیدیم فلز څخه پیل کیږي او په زینون غیر فلز یا نجیب غاز پای ته رسیږي.
په شپږمه دوره کې ۳۲ عناصر شامل دي، چې له سیزیم فلز څخه پیل کیږي او په راډون نجیب غاز پای ته رسیږي. خو ۱۴ عناصر چې په دې دوره کې شامل دي، په جلا توګه د جدول په ښکته برخه کې ښودل کیږي او د لنتانایډونو لړۍ په نوم یادیږي. د شپږمې دورې څخه د لنتانایډونو د جلا کولو دلایل به لاندې تشریح شي.
د عناصرو د دوراني جدول اوومه دوره هم ۳۲ عناصر لري. دا دوره له فرانسیوم فلز څخه پیل کیږي او په اوګاسون عنصر پای ته رسیږي (د اوګاسون عنصر یو بې ثباته عنصر دی او د کیمیاوي خواصو لید یې ستونزمن دي، خو د وروستي قشر د الکتروني ساختمان له پلوه د اتمې اصلي ډلې (۱۸مې) کې ځای پر ځای شوی دی). له اوومې دورې څخه ۱۴ عناصر په جلا توګه د جدول په ښکته برخه کې ښودل کیږي، چې د اکتینایډونو لړۍ په نوم یادیږي.
د لنتانایډونو او اکتینایډونو د جلا ښودلو دلایل:
د بسنده ځای محدودیت: که دا دوه مجموعې عناصر په دورو کې وښودل شي، جدول پراخیږي او خپل مناسبه بڼه له لاسه ورکوي.
د کیمیاوي خواصو ورته والی: لنتانایډونه او اکتینایډونه د کیمیاوي خواصو له پلوه یو بل ته نږدې دي، له همدې امله د هغوی جلا ښودل ډیر د پوهیدو وړ دي.
د f فرعي سویو ډکېدل: په دې عناصرو کې د الکتروني ویش پر مهال f فرعي سویې الکترونونه اخلي.
په لنډه توګه، په دوراني جدول کې د لنتانایډونو او اکتینایډونو ځای پر ځای کول، هم د ځای د محدودیت او هم د هغوی د کیمیاوي خواصو د غوره ښودلو له امله دي.
په دورو کې د لنتانایډونو او اکتینایډونو په ترتیب د دوراني جدول جوړښت. د لویې کچې لپاره، پر انځور کلیک وکړئ.
د عین (یوې) دورې د عناصرو مشترکې ځانګړنې :
د عین دورې عناصر مساوي شمیر الکتروني قشرونه یا مدارونه لري. د بیلګې په توګه: د څلورمې دورې عناصر، هر یو د خپلو اتومونو د هستې شاوخوا څلور الکتروني مدارونه لري.
هره دوره په یوه فعال فلز پیل کیږي او په یوه نجیب غاز (په کیمیاوي تعاملاتو کې لږ فعال) پای ته رسیږي، له اوومې دورې پرته چې په یوه بې ثباته عنصر (اوګاسون) پای ته رسیږي.
په یوه دوره کې فلزي خاصیت په تدریج له کیڼ څخه ښي خوا ته کمیږي او غیرفلزي خاصیت زیاتیږي.
د اتومونو اندازه په تدریج له کیڼ څخه ښي خوا ته کمیږي.
د ولانسي الکترونونو شمیر له کیڼ څخه ښي خوا ته زیاتیږي. د بېلګې په توګه: سوډیم فلز په درېیمه دوره کې یو ولانسي الکترون لري، او د هغې عین دورې عنصر کلورین چې د جدول ښي اړخ ته دی، اوه ولانسي الکترونونه لري.
د عین دورې د عناصرو یو شمیر نور خصوصیات به وروسته په تفصیل سره روښانه شي.
په دوراني جدول کې ډلې
د عناصرو په دوراني جدول کې اووه دورې یا افقي ردیفونه، له ۱۸ عمودي ستنو یا ډلو (دستو) څخه جوړې دي. عناصر په ډلو کې د خپلو کیمیاوي خواصو د ورته والي پر اساس ځای پر ځای کیږي.
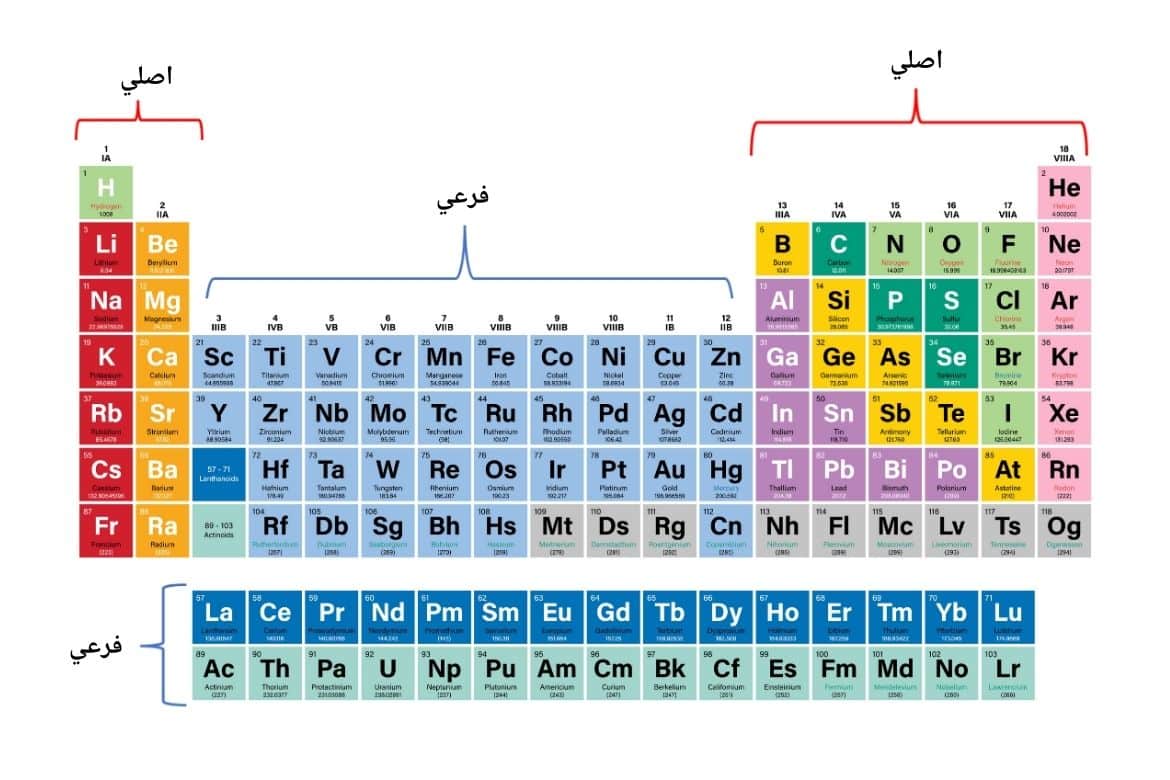
د تناوبي جدول ډلې په دوو اصلي او فرعي برخو ویشل کیږي:
اصلي ډلې (Main groups) : د ۱ تر ۲ او د ۱۳ تر ۱۸ ډلې شاملوي. دا ډلې هغه عناصر دی چې په هغوی s فرعي الکتروني قشرونه د ډکی کېدول په حالت کې دي.
فرعي ډلې (Transition metals) : د ۳ تر ۱۲ ډلې شاملوي. دا ډلې هغه عناصر شاملوي چې په هغوی کې d قشر د ډک کېدلو په حال کې دی. همدارنګه، لنتانایډونه او اکتینایډونه هم د فرعي ډلو برخه ګڼل کیږي.
په ټول کې، دوراني جدول ۸ اصلي ډلې (A) او ۱۰ فرعي ډلې (B) لري.
اصلي ډلې (Main groups)
په دې ګروپ کې د ۱ تر ۲ او د ۱۳ تر ۱۸ ډلې شاملې دي او هغه عناصر پکې شامل دي چې د هغوی s او p فرعي سویې الکتروني قشرونه د ډک کېدلو په حال کې دي. یو شمیر اصلي ډلې په دوراني جدول کې په ځانګړو نومونو یادیږي.
په لاندې جدول کې دا موضوع د هرې ډلې لپاره د مختلفو رنګونو په ټاکلو سره بیان شوې ده.
لاندې به د اصلي ډلو د نومونې دلایل او یو شمیر خصوصیات تشریح کړو:
لومړۍ اصلي ډله کې (IA) فلزات شامل دي: چې لیتیم (Li)، سوډیم (Na)، پوټاشیم (K)، روبیدیم (Rb)، سیزیم (Cs) او فرانسیوم (Fr) فلزونه پکې شامل دي، د القلي فلزاتو په نوم یادیږي. دا عناصر د خپل فوق العاده کیمیاوي فعالیت له امله، په شدت سره له اوبو سره تعامل کوي او قلوي (القلي) مواد جوړوي، لکه: سوډیم هایدروکساید او پوټاشیم هایدروکساید.
هایدروجن عنصر په لومړۍ اصلي ډله کې ځای پر ځای شوی دی. د دې موقعیت لپاره یوازینۍ قانع کوونکې وجه د هایدروجن د الکتروني جوړښت ورته والی د دې ډلې له نورو عناصرو سره ده. هایدروجن د دې ډلې د القلي فلزاتو په څیر یو ولانسي الکترون لري. که نه نو، د نورو خواصو له پلوه له القلي فلزاتو سره ځانګړی ورته والی نلري او خپل ځانګړي خصوصیات لري.
 دویمه اصلي ډله (IIA): چې بیریلیوم (Be)، مګنیزیم (Mg)، کلسیم (Ca)، سټرانشیوم (Sr)، باریوم (Ba) او راډیم (Ra) فلزونه پکې شامل دي، د القلي زمکني فلزاتو په نوم یادیږي. په دې ډله کې شامل عناصر هم له اوبو سره تعامل کوي، خو د تعامل شدت یې نسبتاً ضعیف وي او ضعیف قلوي مواد جوړوي.
دویمه اصلي ډله (IIA): چې بیریلیوم (Be)، مګنیزیم (Mg)، کلسیم (Ca)، سټرانشیوم (Sr)، باریوم (Ba) او راډیم (Ra) فلزونه پکې شامل دي، د القلي زمکني فلزاتو په نوم یادیږي. په دې ډله کې شامل عناصر هم له اوبو سره تعامل کوي، خو د تعامل شدت یې نسبتاً ضعیف وي او ضعیف قلوي مواد جوړوي.
درېیمه اصلي ډله (IIIA) یا ۱۳مه ډله: چې بورون، المونیم (Al)، ګالیوم (Ga)، انډیوم (In)، تالیوم (Tl) او نیهونیوم (Nh) عناصر پکې شامل دي، د بورون ډلې یا زمکني فلزاتو په نوم یادیږي. دې ډلې ته د زمکني فلزاتو ویلو دلیل دا دی چې المونیم عنصر د ځمکې په قشر کې ترټولو نورو عناصر ډیر موجود فلز دی، او د بورون ډلې ویلو دلیل یې دا دی چې لومړنی عنصر یې بورون دی.
۱۴مه یا څلورمه اصلي ډله (IVA): د کاربن (C) ډلې په نوم یادیږي، ځکه چې لومړنی عنصر یې کاربن غیر فلز دی. په دې ډله کې کاربن (C)، سیلیکان (Si)، جرمانیوم (Ge)، قَلعي (Sn)، سُرب (Pb) او فلوریوم (Fl) شامل دي.
۱۵مه یا پنځمه اصلي ډله (VA): د نایتروجن (N2) ډلې په نوم یادیږي، ځکه چې ډله یې په نایتروجن عنصر پیل کیږي. په دې ډله کې د نایتروجن (N) سربیره فاسفورس (P)، ارسینیک (Ar)، انټيموني (Sb)، بسموت (Bi) او موسکوویوم (Mc) شامل دي.
۱۶مه یا شپږمه اصلي ډله (VIA): د اکسیجن (O2) ډلې په نوم یادیږي. لومړنی عنصر یې اکسیجن غیر فلز دی. دا ډله د کلکوژنونو په نوم هم یادیږي. دا نوم یې له یوناني کلمو “کالکوس” (د مس په معنی) او “ژن” (د جوړوونکي په معنی) څخه اخیستل شوی دی. د دې نومونې دلیل دا دی چې د دې ډلې ډیری عناصر د مسو په معدني موادو کې موندل کیږي. په دې ډله کې اکسیجن (O)، سلفر (S)، سیلینیم (Se)، ټیلوریم (Te)، پولونیوم (Po) او لیوموریوم (Lv) شامل دي.
۱۷مه یا اوومه اصلي ډله (VIIA): د هلوجنونو په نوم یادیږي. دا ډله فعال غیر فلزات شاملوي. په دې ډله کې ۵ عناصر په دوه اتومي یا مالیکولي حالت کې قرار لري چې (F2, Cl2, Br2, I2, At2) پکې شامل دي. د هلوجن (Halogen) کلمه د مالګې جوړونکي په معنی ده. په دې ډله کې شامل غیر فلزات د خپل ډیر کیمیاوي فعالیت له امله له فلزاتو سره تعامل کوي او مالګې جوړوي. د بېلګې په توګه: د دسترخوان مالګه یا سوډیم کلوراید (NaCl) چې د دې ډلې د دویم عنصر (Cl2) او سوډیم فلز (Na) څخه جوړیږي. همدارنګه، له اوبو سره په ترکیب کې تیزابونه جوړوي.
۱۸مه یا اتمه اصلي ډله (VIIIA): د صفر ډلې یا نجیبو ګازونو (Noble Gases) په نوم یادیږي. په دې ډله کې شامل ګازونه ټول په یوه اتومي بڼه دي چې شامل دي (He, Ne, Ar, Kr, Xe, Rn, Og). دا ګازونه د کیمیاوي فعالیت له پلوه غیر فعال دي، له همدې امله د نجیبو ګازونو یا بې اغیزې په نوم هم یادیږي. په کیمیاوي تعاملاتو کې د هغوی د کمزورې برخه اخېستنې اصلي دلیل د هغوی د الکتروني سویې بشپړتیا یا په هغوی کې د اکټیټ حالت دی.
په اصلي ډلو کې یو شمیر عناصر شتون لري چې د شبهفلزاتو په نوم یادیږي. شبهفلزات په لاندې جدول کې ښودل شوي دي.
فرعي ډلې (Transition metals) :
دا عناصر د ۳ تر ۱۲ ډلې شاملوي. فرعي ډلې په B توري سره ښودل کیږي، چې (IB, IIB, IIIB, IVB, VB, VIB, VIIB, VIIIB) پکې شامل دي. دا ډلې هغه عناصر شاملوي چې په هغوی کې d سویه د ډک کېدلو په حال کې ده. همدارنګه، لنتانایډونه او اکتینایډونه هم د فرعي ډلو برخه ګڼل کیږي.
 لاندې به د فرعي یا انتقالي ډلو عناصرو اړوند یو شمیر مشخصات تشریح کړو:
لاندې به د فرعي یا انتقالي ډلو عناصرو اړوند یو شمیر مشخصات تشریح کړو:
په فرعي ډلو کې شامل عناصر د منځنۍ ډلو په نوم یادیږي، دلیل یې دا دی چې دا عناصر د دویمې اصلي ډلې (IIA) او درېیمې اصلي ډلې (IIIA) ترمنځ ځای پر ځای شوي دي.
په منځنیو فلزاتو کې په d فرعي سویه کې د ولانسي الکترونونو شتون، له نورو عناصرو یا مالیکولونو سره د کمزورو او قوي کیمیاوي اړیکو د جوړولو امکان برابروي.
په دې ډلو کې شامل ټول عناصر فلزات دي او مشترک فلزي خصوصیات لري.
دا عناصر د انتقالي عناصرو په نوم یادیږي. دلیل یې دا دی چې دا عناصر په کیمیاوي تعاملاتو کې په مختلفو ولانسونو سره ګډون کوي او ددې وړتیا لري چې د خپل وروستي ولانسي قشر د الکترونونو سربیره، له ښکته الکتروني سویو څخه هم الکترون له لاسه ورکړي یا ترلاسه کړي. د بیلګې په توګه: اوسپنه فلز کولی شي په کیمیاوي تعاملاتو کې په (+۲) او (+۳) اکسیدیشن نمبرونو سره ګډون وکړي او له اکسیجن سره دوه ډوله اکسایدونه جوړ کړي: فیرس اکساید (FeO) په (+۲) اکسیدیشن شمېرې سره او فریک اکساید (Fe2O3) په (+۳) اکسیدیشن نمبر سره.
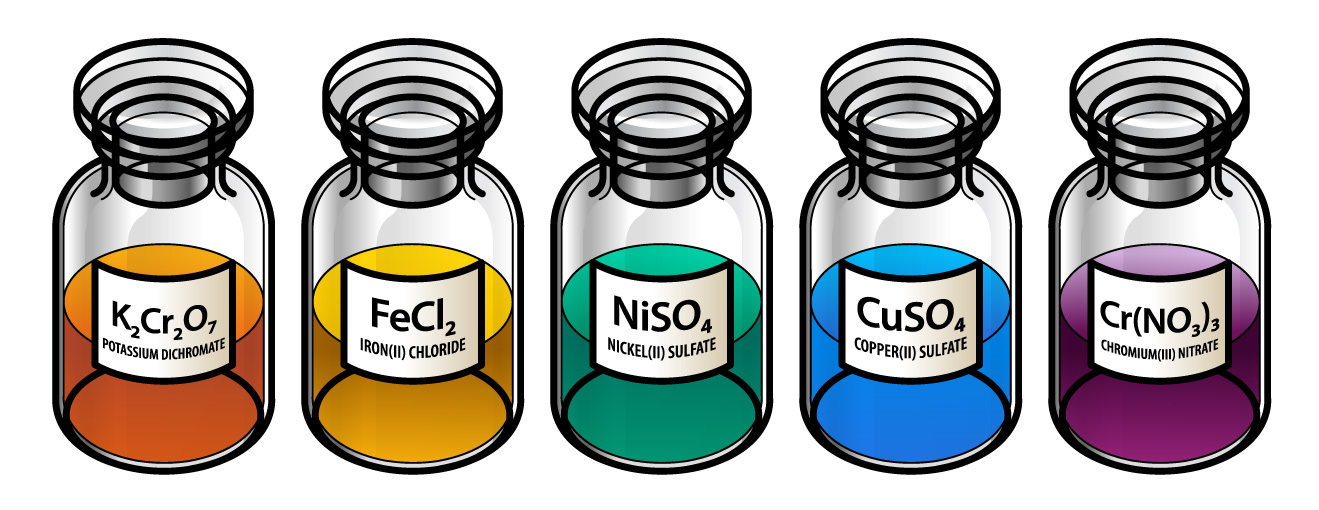
دا عناصر ډیری رنګه مرکبات جوړوي. د هغوی اکسایدونه او مالګې رنګه دي. د بېلګې په توګه: د پوټاشیم کروماټ (K2CrO4) مالګه ژیړ رنګ، د کروم فلز اکساید (Cr2O3) شین رنګ، مسو سلفیټ (CuSO4) آبي رنګ، او پوټاشیم پرمنګنېټ (KMnO4) بنفش رنګ لري.
یو شمیر فلزات چې په فرعي ډلو کې شامل دي، په کیمیاوي تعاملاتو کې د تعاملاتو د تسهیل کوونکي (کاتالیزر) په توګه کارول کیږي. د بیلګې په توګه: پلاتین (Pt) او نیکل (Ni) فلزونه په عضوي تعاملاتو کې د هایدروجنیشن (د هایدروجن نښلول) په پروسه کې اساسي رول لري.
د فرعي ډلو فلزات مغلق یا کمپلکس مرکبات جوړوي. لکه: ټیټرا امین مس (II) سلفیټ ([Cu(NH3)4]SO4)، چې له دې مرکب څخه د مسو آیونونو د تشخیص لپاره کارول کیږي او یو آبي رنګه آبی محلول جوړوي. همدارنګه، اوسپنه فلز چې د وینې په هیوموګلوبین کې د مالیکول په مرکز کې له اکسیجن مالیکول سره کمپلکس جوړوي.
د دوراني جدول په عناصرو کې د فرعي ډلو ډلبندي
په دوراني جدول کې، فرعي ډلې په دوو اصلي برخو ویشل کیږي: بهرني انتقالي عناصر (واسط فلزات) او داخلي انتقالي عناصر (لنتانایډونه او اکتینایډونه). د دې دوو برخو ترمنځ کلیدي توپیرونه په لاندې ډول دي:
په جدول کې ځای : بهرني انتقالي عناصر د دوراني جدول په منځ کې قرار لري او د ۳ تر ۱۲ ډلې پکې شاملي دي، خو داخلي انتقالي عناصر په دوو جلا ردیفونو کې د دوراني جدول په ښکته برخه کې قرار لري.
په الکتروني ویش کې د اوربیټالونو د ډکېدو ډول : په بهرني انتقالي عناصرو کې، د d فرعي سویې اوربیټالونه د ډک کېدل په حال کې دي. خو د داخلي انتقالي عناصرو لپاره، په لنتانایډونو کې د 4f فرعي سویې اوربیټالونه او په اکتینایډونو کې د 5f فرعي سویې اوربیټالونه د ډک کېدلو په حال کې دي.
د بهرني انتقالي عناصرو لپاره باید لاندنې ټکې په پام کې ونیول شي: متغیر ولانسونه، رنګه مرکبات جوړول او د کاتالیزر په توګه کارول.
بهرني انتقالي فلزات د خپلو ځانګړو ځانګړتیاوو له امله په مختلفو صنعتونو کې په پراخه اندازه کارول لري. د بیلګې په توګه: له اوسپنې، مسو او المونیم څخه په ساختماني چارو کې، له طلا او سپین زر څخه په زرګرۍ کې، او له پلاتین او پلادیم څخه په کاتالیزرونو کې کار اخیستل کیږي.
د داخلي انتقالي عناصرو لپاره ډیر ورته کیمیاوي خواص او د عناصرو راډیو اکټیف والی د بهرني انتقالي عناصرو څخه یو ځانګړی شاخص دی.
لاندې جدول په دوراني جدول کې د لنتانایډونو او اکتینایډونو لړۍ موقعیت ښیي.
لنتانایډونه او اکتینایډونه، د داخلي انتقالي عناصرو په توګه، په مختلفو صنعتونو کې په پراخه اندازه کارول کېږي. دلته یې ځینې مهمې کارونې ذکر کیږي:
د لنتانایډونو کارونې:
د مقناطیس جوړول: نیوډیمیم (Nd) او سیماریم (Sm) د ډیرو قوي دایمي مقناطیسونو په جوړولو کې کارول کیږي، چې په بریښنایی موټرو، بادي جنراتورونو، او کمپیوټر هارډ ډیسکونو کې کارول لري.
کاتالیزرونه: سیریم (Ce) د موټرو په کاتالیزوري مبدلونو کې د هوا د ککړتیاوو د کمولو لپاره د کاتالیزر په توګه کارول کیږي.
ښیښې او سرامیک: لانتانیم (La) او سیریم (Ce) د ځانګړو ښیښو په تولید کې کارول کیږي چې ځانګړي نوري او حرارتي خواص لري. دا عناصر په ښیښه سازۍ، سرامیک سازۍ او رنګ جوړولو صنعتونو کې کارول لري.
د لیزر جوړول: نیوډیمیم (Nd) په جامد حالت لیزرونو کې کارول کیږي.
فلورېسنټ لامپونه: یټریم (Y) او یوروپیم (Eu) په فلورېسنټ لامپونو کې د فاسفورس په توګه کارول کیږي.
الکترونیک صنعتونه: ګاډولینیم (Gd) د MRI (مقناطیسي ریزونانس امیجنگ) ټیکنالوژۍ کې کارول لري.
د اکتینایډونو کارونې:
هستوي سونګ: یورانیم (U) او پلوټونیم (Pu) په هستوي بریښناکوټونو کې د سونګ په توګه کارول کیږي.
هستوي وسلې: پلوټونیم (Pu) په هستوي وسلو په جوړولو کې کارول لري.
هستوي درملنه: امریکیم (Am) د هډوکو د کثافت اندازه کولو په وسیلو کې کارول کیږي.
علمي څیړنې: ډیری اکتینایډونه په علمي څیړنو کې، په ځانګړې توګه د هستوي فزیک په برخه کې، کارول لري.
په دې ویډیو کې هم د جدول فزیکي جوړښت، د عناصرو د طبقهبندۍ بنسټ، او د ګروپونو او دورو تشریح شوې ده.