د عناصرو د طبقه بندۍ تاریخچه
د عناصرو د طبقه بندۍ پیل د نوولسمې پېړۍ د تحلیلي کیمیا له پرمختګونو سره تړلی بلل کیږي. د نوولسمې پېړۍ په پیل کې، تحلیلي کیمیا د موادو د کیمیاوي او فزیکي خواصو په پېژندلو کې د پام وړ پرمختګونه وکړل، او دې پرمختګ د هغه وخت د کشف شویو عناصرو د طبقه بندۍ اړتیا پوهانو ته نوره هم ډیره کړه.
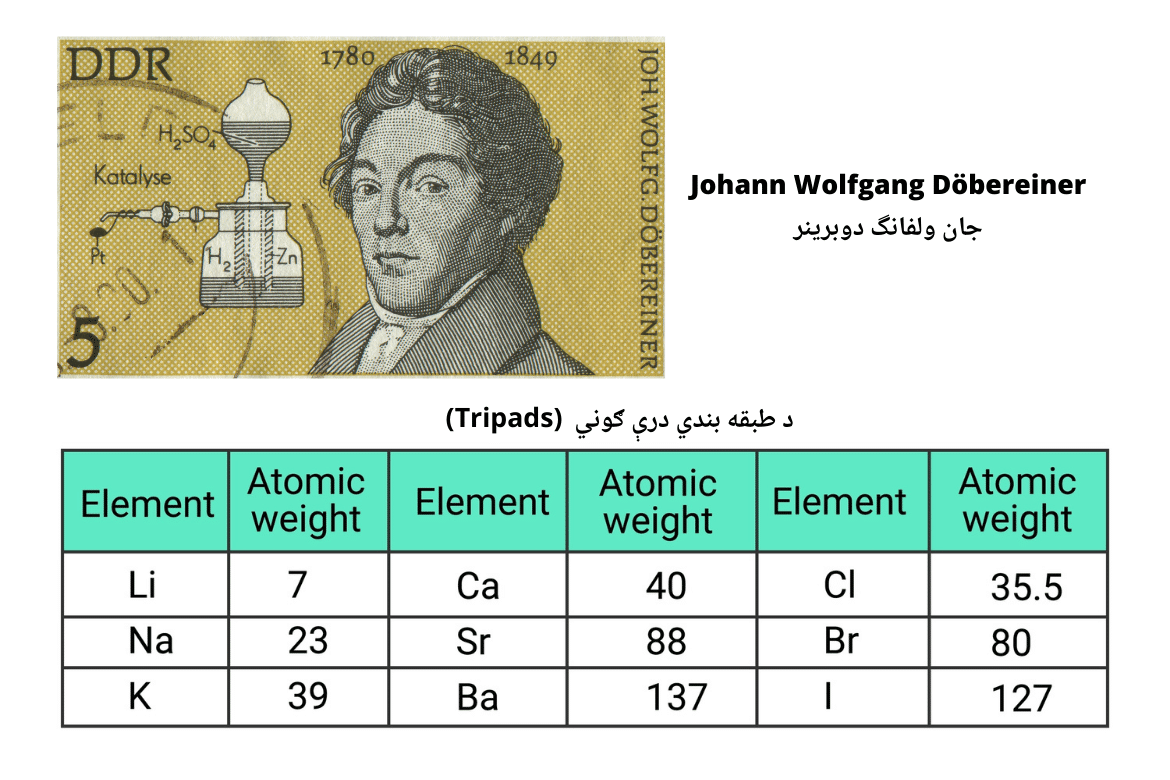
لومړنۍ طبقه بندي په ۱۸۱۷ کال کې د دوبرینر (J.W. Dobereiner) لخوا ترسره شوه. هغه وښودله چې د سټرانشیوم اتومي کتله د کلسیم او باریوم فلزاتو د اتومي کتلو ترمنځ واقع کیږي. هغه خپله دا طبقه بندي درې ګوني (Triads) ونوموله، چې وروسته نورې درې ګوني لکه (کلورین، برومین، آیودین) او (لیتیم، سوډیم، پوټاشیم) هم په دې طبقه بندۍ کې ورزیاتې شوې. خو، په ۱۸۲۷ او ۱۸۵۸ کلونو ترمنځ، د فلورین د هلوجنونو ترمنځ، د مګنیزیم فلز د القلي ځمکني عناصرو ترمنځ، او همدارنګه د اکسیجن، ټیلوریم، سلفر او سیلینیم په یوه ډله کې او د نایتروجن، فاسفورس، ارسنیک، بسموت او انټيموني په یوه بله کورنۍ کې د ځای پر ځای کېدو سره، پوهان دې پایلې ته ورسېدل چې ورته والی له هغه څه ډیر دی چې دوبرینر ویلي وو، او د نورې طبقه بندۍ لپاره هڅې ډیرې شوې.
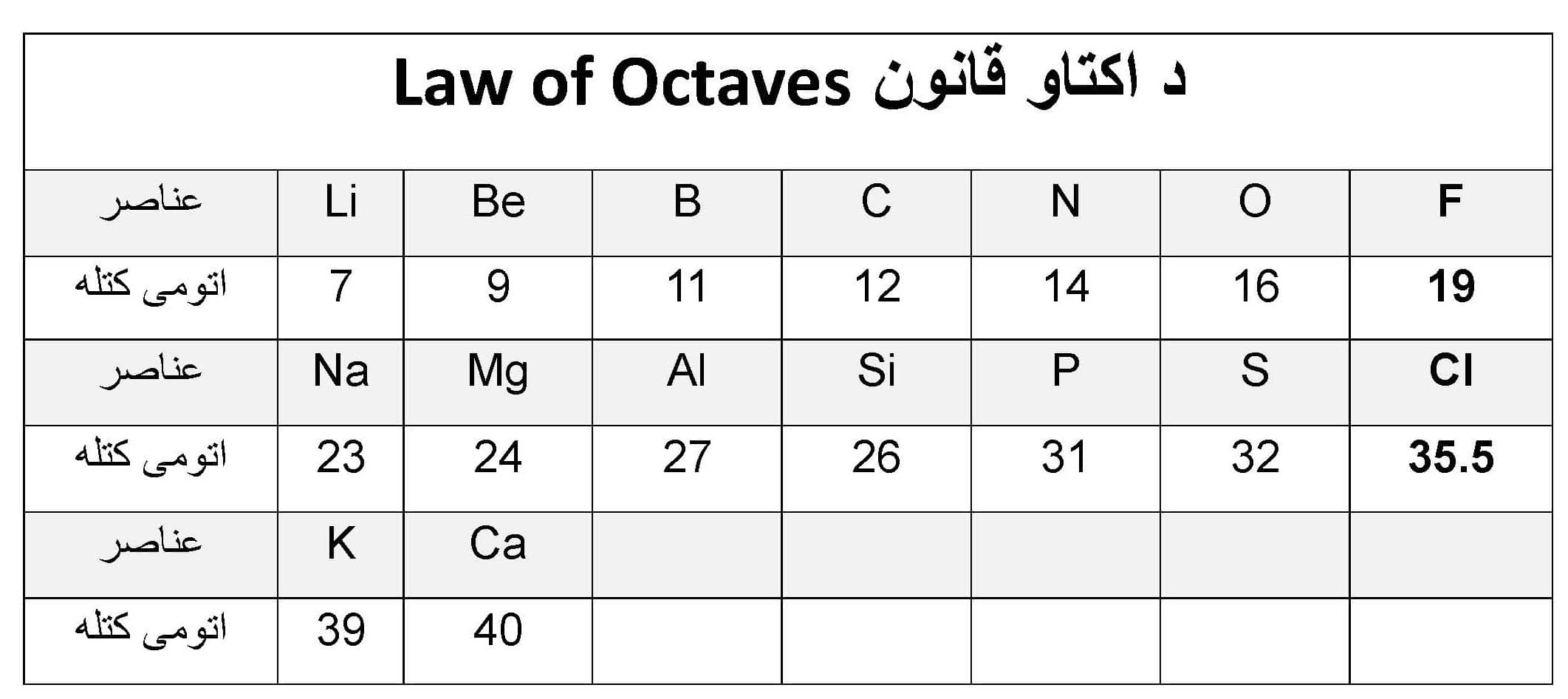
جان نیولندز (John Newlands)، بریتانیاوي کیمیاپوه، په ۱۸۶۴ کال کې د اتومي کتلې پر اساس د عناصرو طبقه بندي وړاندې کړه. عناصر د خپلو اتومي کتلو د زیاتوالي پر اساس په اوو ډلو وویشل شول. په عین ډله کې شامل عناصرو د خپل سرګروپ په څیر ورته خواص درلودل. دې ویشونکي قاعدې ته د اکټاو قانون (Law of Octaves) ویل کیږي، ځکه چې ورته خواص په عناصرو کې د هر اته عنصر وروسته تکراریږي. هغه عناصر چې د نیولندز په جدول کې د هرې ډلې په پیل کې ځای پر ځای شوي وو، په ترتیب سره: هایدروجن، لیتیم، بیریلیوم، بورون، نایتروجن او اکسیجن وو. د بېلګې په توګه، که له لیتیم څخه حساب پیل شي تر اتو پورې، سوډیم عنصر ته رسیږو چې له لیتیم سره په خواصو کې ورته دی. د اکټاو نوم د موسیقۍ په ګامونو کې د اوو فاصلو د نوم ورته والي څخه اخیستل شوی و.
د نیولندز لخوا د اکټاو طبقه بندي په لاندې جدول کې ښودل شوې ده:
دیمتري مندلیف (Dmitri Mendeleev)، روسي کیمیاپوه، په ۱۸۶۹ کال کې د تناوب قانون وړاندې کړ. هغه د عناصرو خواص له اتومي کتلې سره تړلي بلل. د مندلیف د قاعدې پر اساس، هغه عناصر چې د خپلو اتومي کتلو د زیاتوالي پر اساس ترتیب شوي وي، ورته خواص له ځانه ښیي.
د یادولو وړ ده چې لوتارمایر (Lothar Meyer)، آلماني کیمیا-فزیکپوه، هم په جلا توګه دا مطلب د مندلیف له مقالې وروسته خپور کړ.
د مندلیف جدول د عناصرو د طبقه بندۍ لپاره ښودل شوی.
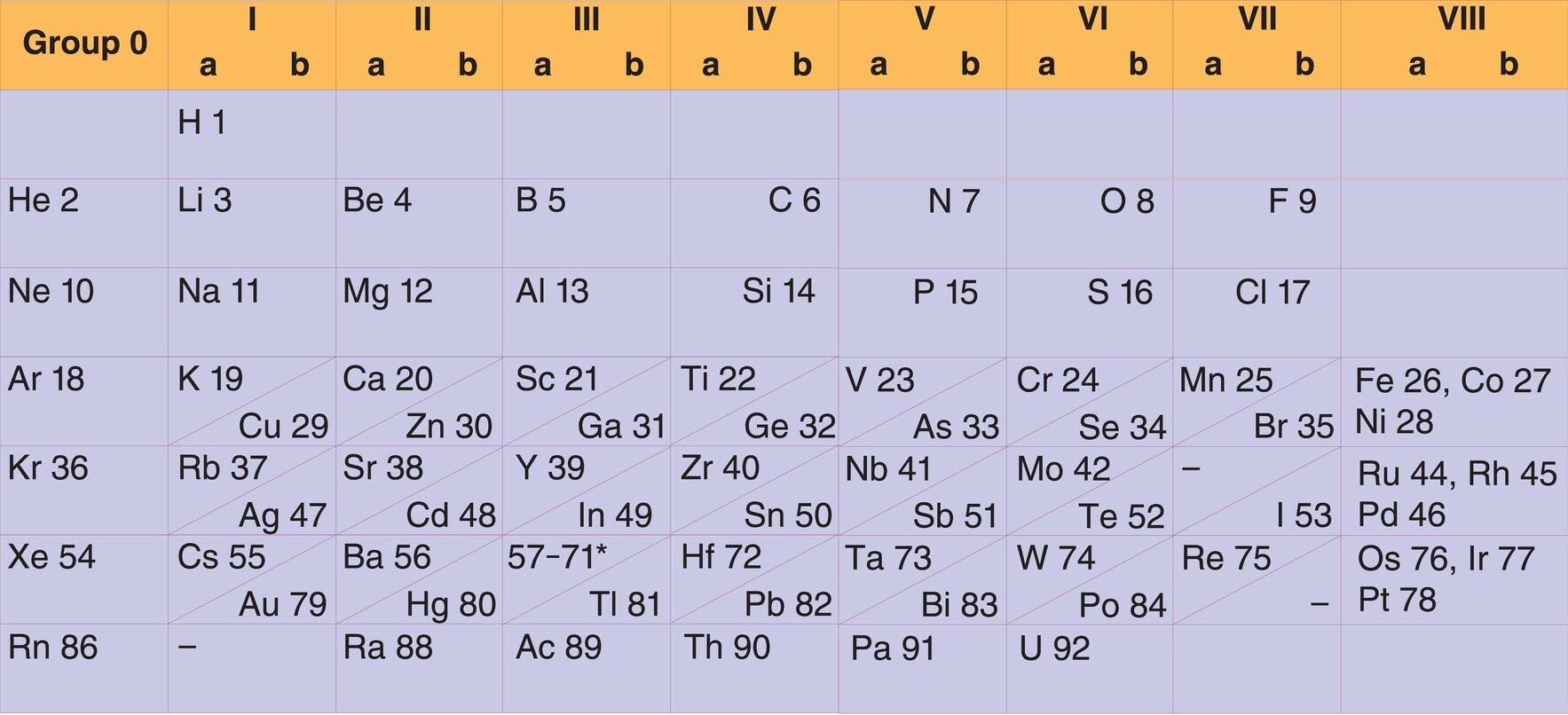
د مندلیف جدول ۱۷ ستونونه درلودل. په دې ترتیب شوي جدول کې دوه بشپړې دورې وی. یوه دوره له پوټاشیم څخه پیل شوې او په بورون پای ته رسیدلې، او دویمه دوره له روبیدیم څخه پیل شوې او په آیودین پای ته رسیدلې. دوه ردیفونه وو چې هر یو یې اوه، اوه عناصر درلودل (لیتیم تر فلورین) او (سوډیم تر کلورین). همدارنګه درې نیمګړي دورې یا ردیفونه پکې شامل وو.
مندلیف په ۱۸۷۱ کال کې خپل ترتیب شوی جدول بیا ولیکه او د ۱۷ عناصرو ځای یې بدل کړ. دا ځل یې یو اته ستوني جدول ترتیب کړ. اته ستونونه اووه دورې یا ردیفونه درلودل او هر ردیف یې اوه عناصر درلودل. په اتم ستون کې درې فلزونه د مرکزي عنصر په توګه شامل وو، چې عبارت وو له: اوسپنه، کوبالټ او نکل. مندلیف په خپله نوې اصلاح کې مس له لومړۍ ډلې څخه اتمې ډلې ته انتقال کړ.
د مندلیف مجسمه او هغه برجسته نقش چې د کیمیاوي عناصرو لپاره د هغه شاهکاري (دوراني جدول) انځوروي.
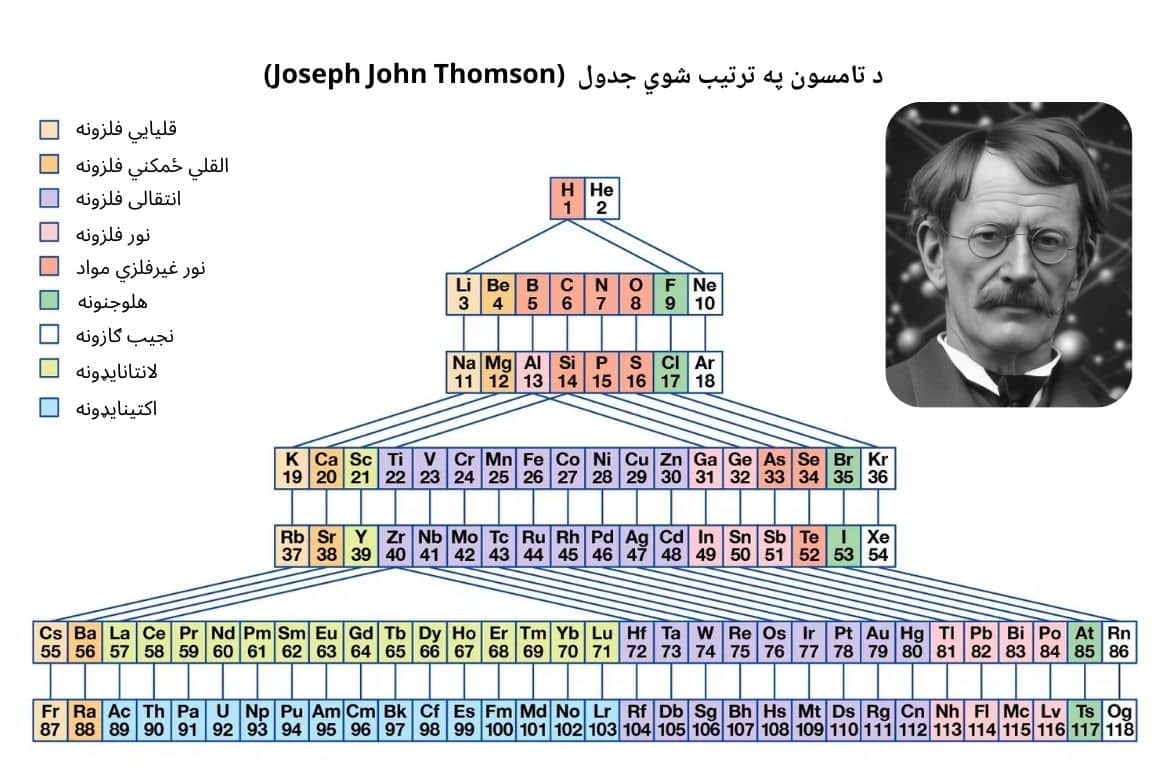
جوزیف جان تامسون (Joseph John Thomson)، انګلیسي فزیکپوه، په ۱۸۹۵ کال کې د جدول لپاره یو نوی ماډل وړاندې کړ. د تامسون جدول هغه دورې درلودې چې په ترتیب سره اوږدېدلې. د جدول تناوبونه دوه عناصر، اته عناصر، اتلس عناصر او دوه دېرش عناصر درلودل.
د تامسون په ترتیب شوي جدول کې، د یوې دورې عناصر په مستقیمو خطونو سره له هغو عناصرو سره تړلي وو چې په نورو دورو کې یې د کیمیاوي خواصو له پلوه ورته والی درلود. دې کار جدول یو څه پېچلی کړی و. همدارنګه په عین دوره کې د ۳۲ عناصرو ځای پر ځای کول او له نورو دورو عناصرو سره د هغوی تړاو چې په خواصو کې ورته وو، کار نور هم جنجالي کړی و. په تامسون وړاندې شوي جدول کې، لنتانایډونه او اکتینایډونه له داخلي انتقالي عناصرو سره یوځای، ځای پر ځای شوي وو.
د نورو عناصرو په کشف سره په جدول کې بدلونونه
د نورو عناصرو په کشف، په تېره بیا نجیبو ګازونو، مندلیف او نورو پوهانو د پخوانیو ترتیب شویو جدولونو د پراختیا لپاره هڅې وکړې. د نجیبو ګازونو په کشف سره، د مندلیف په جدول کې صفر ډله ورزیاته شوه. د نجیبو ګازونو لرونکی جدول تر ۱۹۳۰ کال پورې کارول کیده. دا جدول د مندلیف له جدول سره لږ توپیر درلود.
د تناوب قانون لوړ ارزښت هغه وخت مشخص شو چې مندلیف دې ته پام شو چې، د ۱۷ عناصرو ترمنځ ورته خواص، له نورو عناصرو سره تړاو لري. هغه دا کار د ۱۷ عناصرو په جدول کې د اتومي کتلې د زیاتوالي پر اساس په ترتیبولو سره ترسره کړ. د مندلیف لخوا دې بدولون وښودله چې د عناصرو د اتومي کتلې په اندازه کولو کې لږه خطا شته. همدارنګه، په دې بدلون سره هغه د یو شمیر عناصرو د اتومي کتلو په اندازه کولو کې په لویو تېروتنو پوه شو.
سره له دې چې د عناصرو د اتومي کتلو په اندازه کولو کې د اصلاح هڅه وشوه، یو شمیر عناصر په هغه جدول کې چې د مندلیف او لوتارمایر لخوا ترتیب شوی و، باید د اتومي کتلې پرته د بل مفهوم پر اساس تنظیم شوي وای. په مندلیف په جدول کې د پام وړ ستونزې د ارګون – پوټاشیم، کوبالټ – نکل او ټیلوریم – آیودین د عناصرو په جوړو کې لیدل کیدې، چې پخواني عناصر یې د وروستیو عناصرو په پرتله زیاته اتومي کتله درلوده. دې ستونزې د اتوم د ساختمان په اړه په ډیر پوهیدلو سره حل وموند.
د برقي چارچ او ایزوتوپونو په کشف سره په جدول کې بدلونونه
ارنیست رادرفورد (Ernest Rutherford)، نیوزیلنډي فزیکپوه، په ۱۹۱۰ کال کې، د درنو اتومونو هستې لخوا د الفا ذراتو د خپریدو پر خاصیت باندې په تجربه کولو سره، د اتوم په هسته کې د برقي چارچ په کشفولو بریالی شو. د هستې چارچ د الکترون چارچ په پرتله د اتومي کتلې شاوخوا نیمایي برخه یاد شوی دی.
په ۱۹۱۱ کال کې انتونیوس وان دن بروک (Antonius van den Broek)، آلماني ساینسپوه، د اتومونو هسته(زړې) کې شته چارچونه اتومي نمبر وبلل او لومړنی کس و چې په دوراني جدول کې یې د عناصرو لپاره مناسب موقعیتونه تشخیص کړل.
دا وړاندیز په ۱۹۱۳ کال کې هغه مهال ثابت شو چې هنري موزلي (Henry Moseley) د ډیری عناصرو لپاره د ایکس شعاع خطي طیف د موج اوږدوالی اندازه کاوه. د موزلي اندازه ګیریو وښودله چې د هر عنصر لخوا د ایکس شعاع موج اوږدوالی په جدول کې د عناصرو اتومي نمبر سره ښه تړاو لري. له همدې ځایه، د هنري موزلي لخوا د اتومي نمبر پر اساس د عناصرو د طبقه بندۍ نوې او مناسبه طریقه وړاندیز شوه او عناصر په اوسنۍ بڼه طبقه بندي شول.
د ایزوتوپونو معرفي کول او د اتوم د جوړښت په پېژندنه کې پرمختګ دوه نور موارد وو چې د اتومي کتلې پر اساس یې د تناوب قانون وننګاوه.
د ایزوتوپونو په معرفي کولو سره، په جدول کې د اتومي کتلې پر اساس د انتخاب شویو ځایونو، نه تړاو څرګند شو. ایزوتوپونه د عین اتوم هغو هستو ته ویل کیږي چې د برقي چارچ (د پروتونونو او الکترونونو شمیر) له پلوه یو شان وي، خو په اتومي کتله کې توپیر لري. همدارنګه، د عین عنصر ایزوتوپونه د کیمیاوي خواصو له پلوه یو شان دي.
د اتوم د الکتروني ساختمان او د کوانټم تیوري په پېژندنه کې پرمختګ، چې په ۱۹۱۳ کال کې د نیلزبور (Niels Bohr) لخوا پیل شو، د تناوب قانون په دقیق پوهیدلو کې مرسته وکړه. همدارنګه، د پاولي د طرد اصل (Pauli exclusion principle) په ۱۹۲۵ کال کې (چې وایي په یوه اتوم کې هیڅ دوه الکترونونه نشي کولی چې څلور واړه کوانټمي شمیرې یو شان ولري)، او په همدې کال کې د هایزنبرګ او شروډینګر لخوا د کوانټم میخانیک پراختیا هغه ګامونه وو چې پورته شول. همدارنګه، په ۱۹۱۶ کال کې د لویس لخوا د ولانسي تیوري پراختیا هم د تناوب قانون په پراختیا کې ډیر مهم رول درلود.