د دوراني جدول په پېژندلو سره د عناصرو د خواصو وړاندوینه
د عناصرو د تناوبي جدول (Periodic table of elements) سمه پېژندنه له موږ سره مرسته کوي چې د عناصرو د ډېرېو ځانګړتیاوو، وړاندوینه وکړو. په راتلونکو کرښو کې به هغه موارد تشریح کړو چې د دوراني جدول په سم پېژندلو سره یې موږ د عناصرو لپاره وړاندوینه کولی شو.
- د عناصرو الکتروني جوړښت
- فلزي او غیرفلزي خاصیت
- اتومي وړانګه
- الکترونيګاتيويتي خاصیت
- الکتروپوزیټيف خاصیت
- د الکترون غوښتنې خاصیت
- د آیونایزېشن انرژي (انرژي آیونایزیشن)
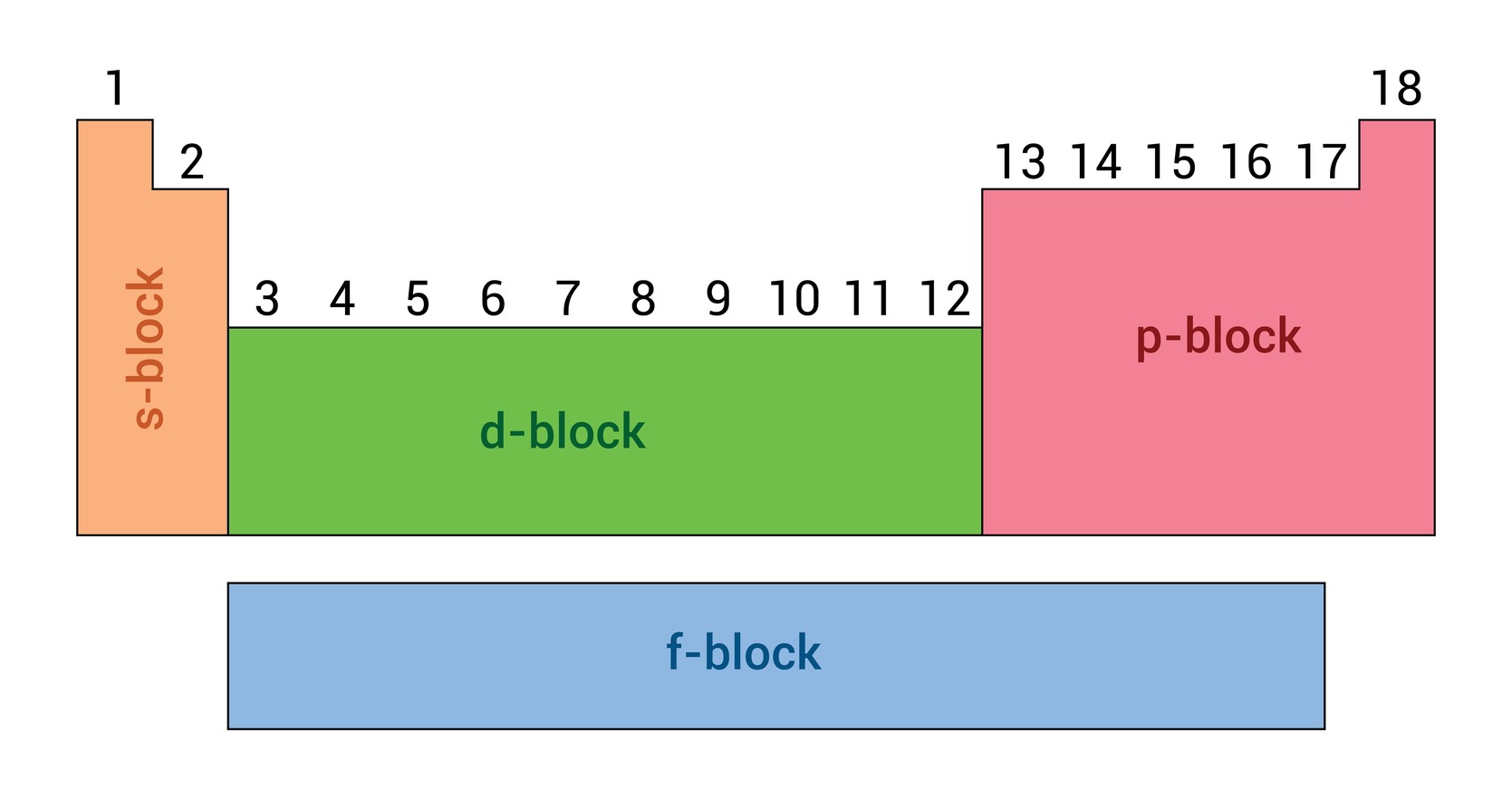
د عناصرو الکتروني جوړښت پر اساس د دوراني جدول ډلبندي
د عناصرو تناوبي جدول د عناصرو د الکتروني جوړښت پر بنسټ، په ځانګړې توګه په فرعي سویو یا اوربیټالونو کې د ولانسي الکترونونو د ځای پر ځای کېدو له مخې په څلورو بلاکونو (s,p,d,f) وېشل شوی دی. په بل عبارت، هر بلاک دا په ګوته کوي چې د یو عنصر وروستی الکترون په کوم ډول اوربیټال کې ځای نیسي. s,p,d,f توري د اوربیټالونو له نومونو څخه اخیستل شوي دي. په بلاکونو کې د عناصرو دا ډلبندي له مونږ سره د عناصرو د فزیکي او کیمیاوي خواصو په پېژندلو کې مرسته کوي.
دلته به د دوراني جدول د هر بلاک په اړه لنډه توضیح وړاندې کړو:
- (s) بلاک :
دا بلاک د لومړۍ اصلي ډلې (IA) او دویمې اصلي ډلې (IIA) عناصر رانغاړي. په دې عناصرو کې وروستی الکترون د s اوربیټال کې ځای پر ځای دی.
په ټولیز ډول، دا عناصر په کیمیاوي تعاملاتو کې ډېر فعال دي. (هایدروجن او هیلیوم هم په دې بلاک کې شامل دي).
- (p) بلاک :
دا بلاک د ۱۳ تر ۱۸ اصلي ډلو (IIIA تر VIIIA) عناصر رانغاړي. په دې عناصرو کې په الکتروني وېش کې وروستی الکترون د p اوربیټال یا فرعي سویه کې ځای پر ځای دی.
دا بلاک درې مختلف ډوله عناصر: فلزونه، غیرفلزونه او شبهفلزونه رانغاړي.
- (d) بلاک :
دا بلاک د بهرني انتقالي عناصرو په نوم یادیږي چې د ۳ تر ۱۲ فرعي ډلو (IB تر VIIIB) عناصر پکې ځای لري.
په دې عناصرو کې وروستی الکترون د d اوربیټال کې ځای پر ځای دی.
په ټولیز ډول، په دې بلاک کې شامل فلزات د ویلې کېدو لوړه نقطه لري او سخت وي.
- (f) بلاک :
دا بلاک لنتانایډونه او اکتینایډونه رانغاړي چې د دوراني جدول په لاندې برخه کې ځای پر ځای شوي دي. په دې عناصرو کې وروستی الکترون د f اوربیټال کې ځای پر ځای دی. په دې بلاک کې شامل عناصر د کیمیاوي خواصو له پلوه یو بل ته ډېر نږدې دي.
- په لاندې جدول کې د بېلابېلو بلاکونو لپاره د عناصرو د اتومونو د وروستیو الکترونونو شمېر ښودل شوی دی.
د بلاکونو او اوربیټالونو د نومونې ريښه (f, d, p, s)
- (s) توری : دا توری له “sharp” (تېز) کلمې څخه اخیستل شوی دی. د s اوربیټالونو اړوند طیفي کرښې ډېرې تېزې او مشخصې وي.
- (p) توری : دا توری له “principal” (اصلي) کلمې څخه اخیستل شوی دی. د p اوربیټالونو اړوند طیفي کرښې قوي او روښانه وي.
- (d) توری : دا توری له “diffuse” (خپرېدونکي) کلمې څخه اخیستل شوی دی. د d اوربیټالونو اړوند طیفي کرښې خپرې شوې او پیکه وي.
- (f) توری : دا توری له “fundamental” (اساسي) کلمې څخه اخیستل شوی دی. د f اوربیټالونو اړوند طیفي کرښې پیچلې او اساسي وي.
په دې ویډیو کې هم د عناصرو د تناوبي جدول د بلاکبندۍ تشریح شوې ده.
فلزي او غیرفلزي خاصیت
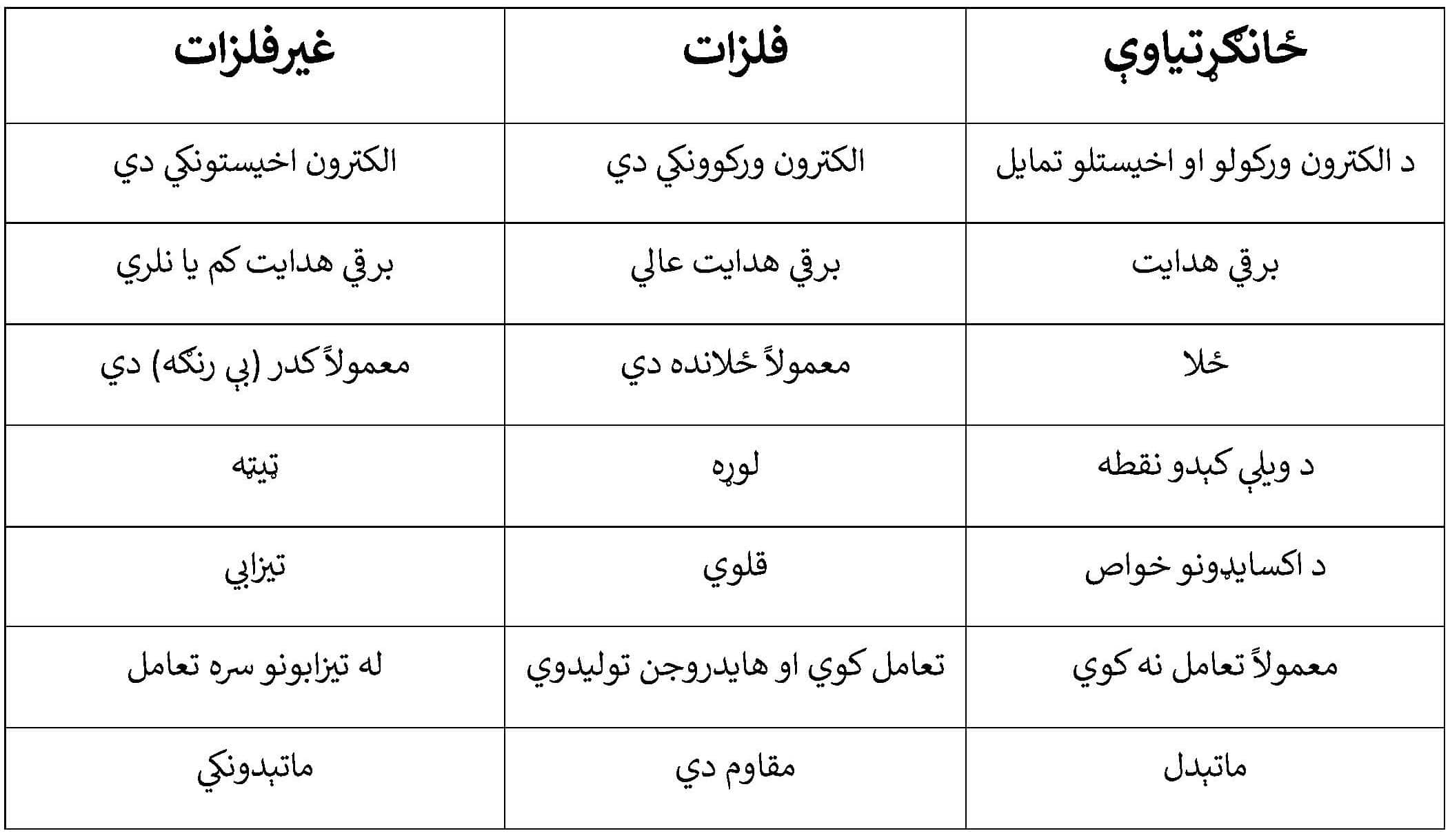
فلزي او غیرفلزي خاصیت د دوراني جدول د عناصرو دوه مهمې ځانګړتیاوې دي چې د هغوی په کیمیاوي او فزیکي چلند کې اساسي توپیرونه رامنځته کوي.
لاندې جدول د فلزي او غیرفلزي عناصرو ځینې ځانګړتیاوې پرتله کوي:
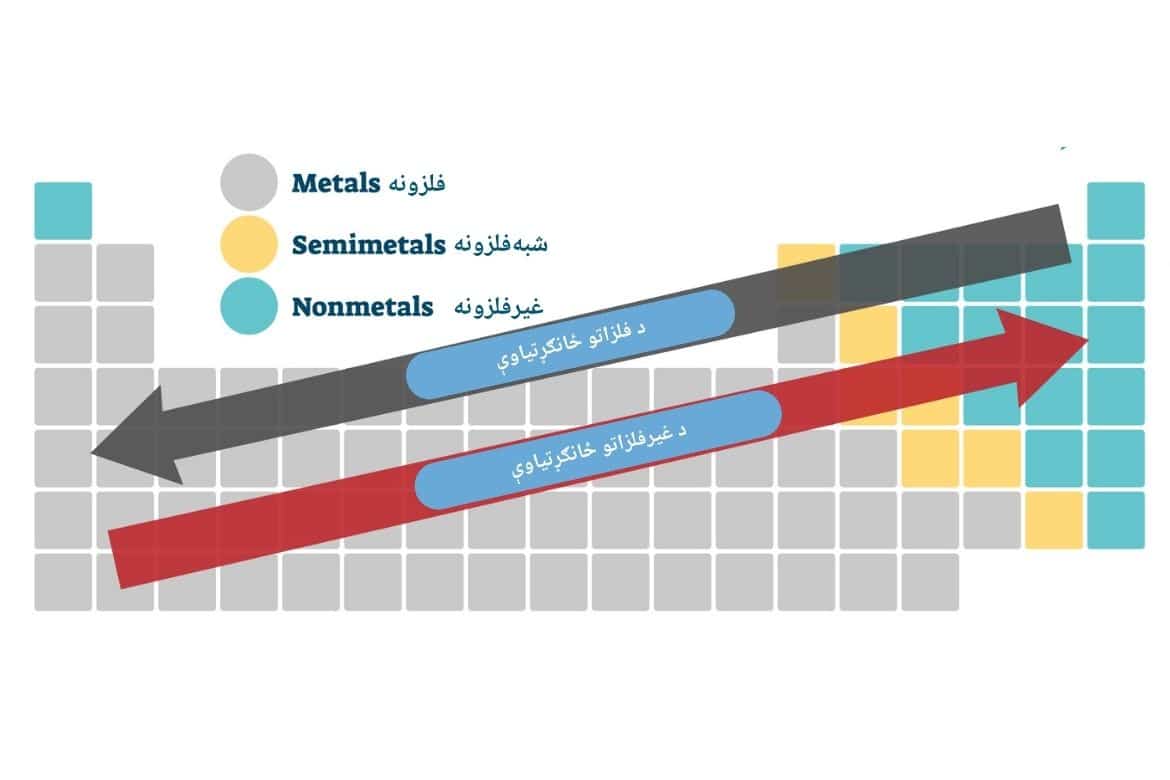
د عناصرو په دوراني جدول کې فلزي او غیرفلزي خواص په لاندې ډول وړاندوینه کېدای شي:
په لنډه توګه د فلزي او غیرفلزي خواصو بدلون:
فلزي ځانګړنه : په هر تناوب کې له کیڼ څخه ښي خوا ته کمیږي او په هره ډله کې له پاسه لاندې ته زیاتیږي.
غیرفلزي ځانګړنه: په هر تناوب کې له کیڼ څخه ښي خوا ته زیاتیږي او په هره ډله کې له لاندې څخه پاسه ته زیاتیږي.
اتومي وړانګه (Atomic Radius)
اتومي وړانګه د هر عنصر لپاره یوه مهمه ځانګړتیا ده، چې پر اساس یې د عناصرو یو شمېر کیمیاوي (د تعامل وړتیا) او فزیکي خواص (د جوش نقطه او کثافت) وړاندوینه کېدای شي.
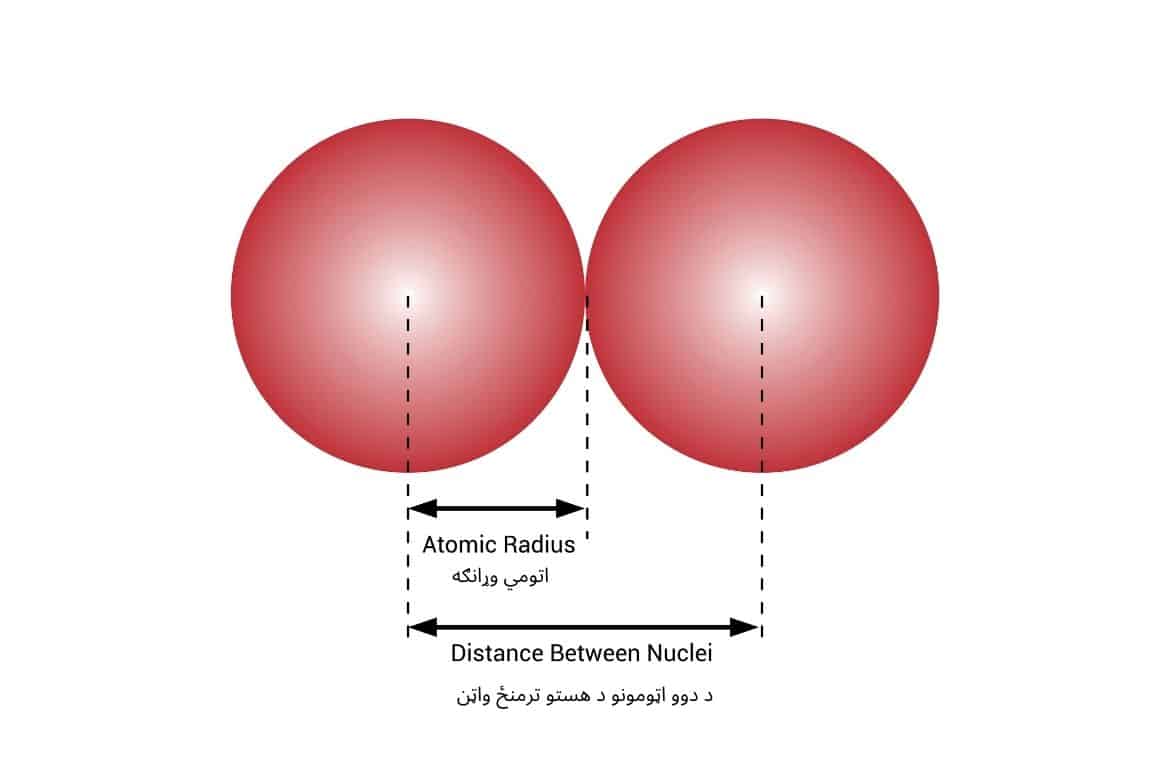
اتومي وړانګه د یوه اتوم د هستې او د هغې تر وروستۍ الکتروني سویې تر منځ فاصله بلل کیږي. همدارنګه، د دوو نږدې اتومونو د هستو تر منځ نیمه فاصله هم اتومي وړانګه بلل کېږي.
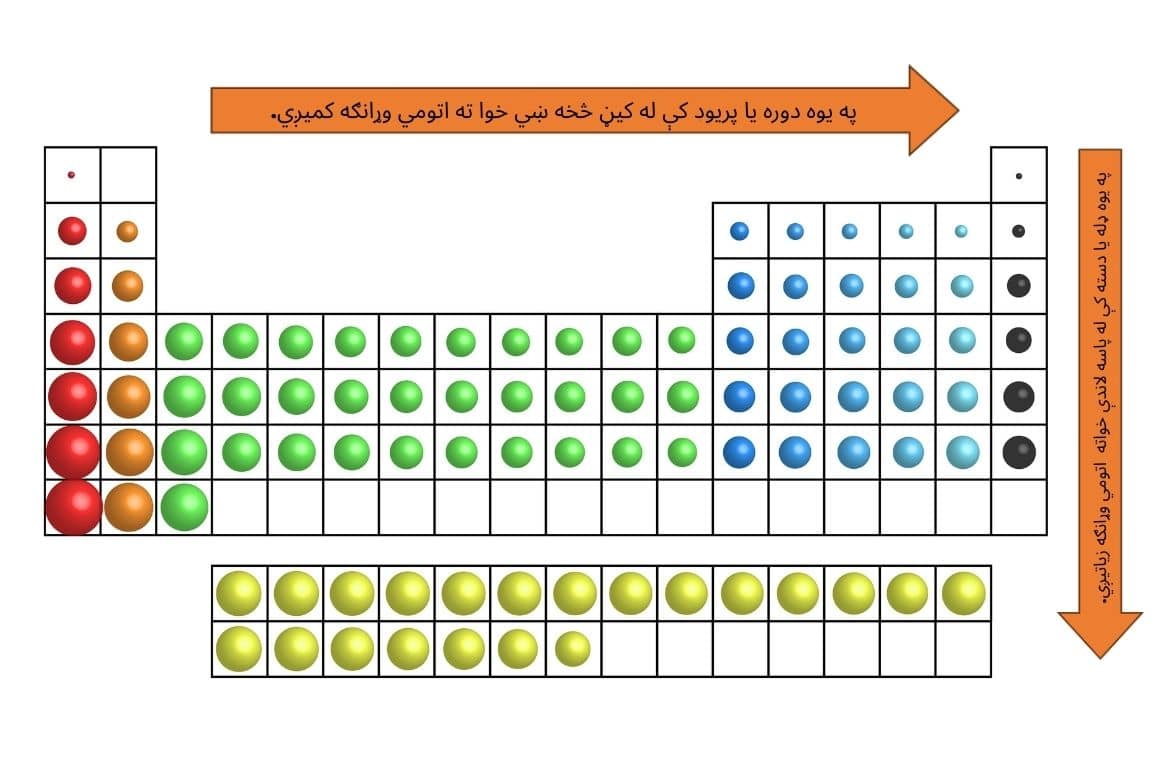
 د دوراني جدول کې د عناصرو د موقعیت پر بنسټ د اتومي وړانګې بدلون په لاندې ډول دی:
د دوراني جدول کې د عناصرو د موقعیت پر بنسټ د اتومي وړانګې بدلون په لاندې ډول دی:
 په لنډه توګه د اتومي وړانګې بدلون:
په لنډه توګه د اتومي وړانګې بدلون:
په ډلو کې: په یوه ډله یا دسته کې له پاسه لاندې خواته اتومي وړانګه زیاتیږي. دلیل یې د الکتروني قشرونو یا سویو په شمېر کې زیاتوالی دی. د الکتروني سویو په زیاتېدو سره، بهرني الکترونونه له هستې څخه لرې کیږي او په پایله کې اتومي وړانګه زیاتیږي.
په دورو کې: په یوه دوره یا پريود کې له کیڼ څخه ښي خوا ته اتومي وړانګه کمیږي. دلیل یې د هستوي چارچ یا په اتوم کې د پروتونونو د شمېر زیاتوالی دی. د پروتونونو په زیاتېدو سره، د هستې او الکترونونو تر منځ د جاذبې قوه زیاتیږي او په پایله کې الکترونونه هستې ته نږدې کیږي.
په دې ویډیو کې د عناصرو د فلزي او غیر فلزي ځانګړتیاوو متناوب بدلونونه او همدارنګه د عناصرو اټومي شعاع تشریح شوې ده.
د الکترونيګاتيويتي او الکتروپوزیټيويتي خاصیت
د الکترونيګاتيويتي او الکتروپوزیټيويتي دوه خاصیتونه په کیمیاوي اړیکو کې د عناصرو د اتومونو د چلند سره تړاو لري، چې لاندې به یې د دوراني جدول په اړه د هغوی بدلونونه تشریح کړو.
الکترونيګاتيويتي (Electronegativity):
الکترونيګاتيويتي د کیمیاوي اړیکو په جوړولو کې د الکترونونو د جذبولو لپاره د یوه اتوم تمایل ته ویل کیږي. په بل عبارت، دا په ګوته کوي چې یو اتوم څومره کولی شي الکترونونه خپلې خوا ته راکش کړي.
د دوراني جدول د عناصرو په منځ کې، فلورین (Fluorine) غیرفلز د الکترون د جذبولو تر ټولو لوړ ځواک لري او د الکترونيګاتيويتي عدد یې 4 دی. په مقابل کې، په لومړۍ ډله کې شامل القلي فلزات تر ټولو کمه الکترونيګاتيويتي لري. هغه عناصر چې الکترون اخلي، الکترونيګاټيف بلل کیږي.
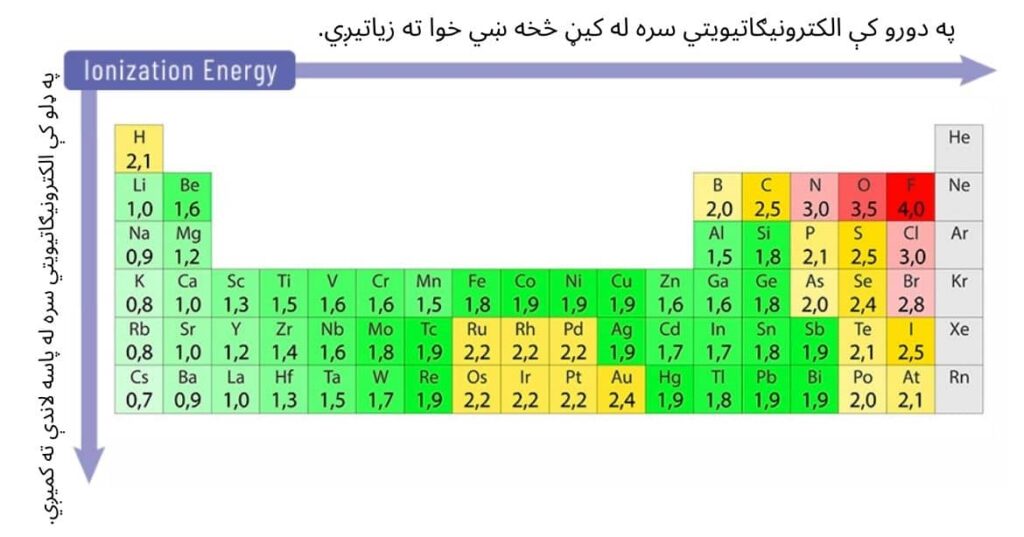
په دوراني جدول کې د عناصرو د الکترونيګاتيويتي خاصیت وړاندوینه په لاندې ډول کیدای شي:
- په دورو کې: د هستوي چارچ په زیاتېدو سره له کیڼ څخه ښي خوا ته زیاتیږي. لکه څرنګه چې د دوراني جدول په ښي خوا کې په اوومه ډله کې فلورین عنصر ترټولو لویه الکترونيګاتيويتي لري.
- په ډلو کې: د هستوي چارچ په زیاتېدو سره له پاسه لاندې ته کمیږي. لکه څرنګه چې فرانسیوم (Fr) فلز د لومړۍ اصلي ډلې (IA) په پای کې ترټولو کمه الکترونيګاتيويتي (0.79) لري.
الکتروپوزیټيويتي (Electropositivity):
دا خاصیت د الکترونيګاتيويتي برعکس عمل کوي. یعنې د یوه اتوم لخوا د الکترونونو له لاسه ورکولو تمایل ته الکتروپوزیټيويتي ویل کیږي. هغه عناصر چې الکترون ورکوونکي وي، الکتروپوزیټيف بلل کیږي. د عناصرو په منځ کې، فلزات لوړ الکتروپوزیټيف خاصیت لري او دا خاصیت د فلزاتو لپاره د یوې مهمې ځانګړتیا په توګه پېژندل کیږي.
په دوراني جدول کې د عناصرو د الکتروپوزیټيويتي خاصیت وړاندوینه په لاندې ډول کیدای شي:
- په دورو کې: په اتومونو کې د هستوي چارچ په زیاتېدو سره له کیڼ څخه ښي خوا ته کمیږي. لکه څرنګه چې د لومړۍ اصلي ډلې فلزات ترټولو الکتروپوزیټيف عناصر دي او د اوومې اصلي ډلې غیرفلزات د کمزورو الکتروپوزیټيف په ډله کې دي.
- په ډلو کې: د الکتروني قشرونو په زیاتېدو سره له پاسه لاندې ته زیاتیږي.
لاندې جدول په دورو او ډلو کې د الکترونيګاتيويتي خواصو بدلون ښیي.
 پخوا یادونه وشوه چې دا دوه خاصیتونه یو له بل سره متضاد دي، پدې معنی چې یو اتوم نشي کولی په ورته وخت کې قوي الکترونيګاټيف او قوي الکتروپوزیټيف وي.
پخوا یادونه وشوه چې دا دوه خاصیتونه یو له بل سره متضاد دي، پدې معنی چې یو اتوم نشي کولی په ورته وخت کې قوي الکترونيګاټيف او قوي الکتروپوزیټيف وي.
د دوو اتومونو تر منځ د الکترونيګاتيويتي توپیر په پېژندلو سره، موږ کولی شو د هغوی ترمنځ د کیمیاوي اړیکې ډول وړاندوینه وکړو:
- که د الکترونيګاتيويتي توپیر ډېر وي، برقي یا آیوني اړیکه جوړیږي.
- که د الکترونيګاتيويتي توپیر منځنی وي، قطبي اشتراکي اړیکه جوړیږي.
- که د الکترونيګاتيويتي توپیر کم وي، غیرقطبي اشتراکي یا کولانسي اړیکه جوړیږي.
د نجیبو ګازونو لپاره، څرنګه چې د دوی الکتروني قشرونه په بشپړه توګه ډک دي، نو دا عناصر کیمیاوي اړیکو ته لیوالتیا نلري او د هغوی لپاره د الکترونيګاتيويتي عدد نه دی وړاندیز شوی. همدارنګه، د لنتانایډونو او اکتینایډونو لړۍ چې پېچلي کیمیاوي خواص ښیي، د الکترونيګاتيويتي د ټاکلو لپاره له ځانګړي بهیر څخه پیروي نه کوي.
د آیونایزېشن انرژي (Ionization Energy)
اتومونه د ګاز په حالت کې د الکترونونو د جلا کولو لپاره انرژي ته اړتیا لري. هغه انرژي چې د ګاز په حالت کې له یوه بې طرفه اتوم څخه د الکترون جلا کولو ته اړتیا لري، د آیونایزېشن انرژي بلل کیږي. دا انرژي د اتومونو لپاره له الکترونيګاتيويتي سره متضاد مفهوم لري. هر څومره چې د یوه اتوم د آیونایزېشن انرژي کمه وي، په هماغه اندازه په اسانۍ سره الکترون له لاسه ورکوي او په کټیون (مثبت چارچ لرونکی آیون) بدلیږي.
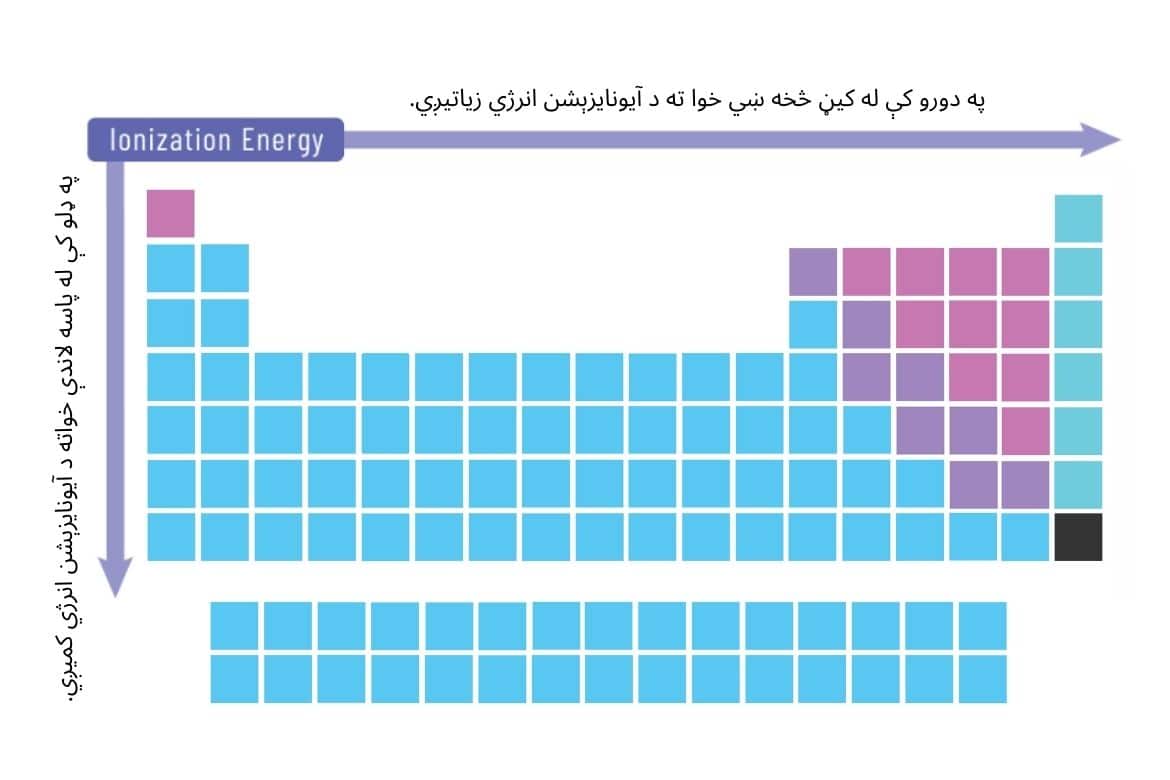
د دوراني جدول په عناصرو کې د آیونایزېشن انرژي بدلون وړاندوینه په لاندې ډول کېدای شي.
 په لنډه توګه د آیونایزېشن انرژي بدلون:
په لنډه توګه د آیونایزېشن انرژي بدلون:
- په دورو کې: د اتومي نمبر (هستوي چارچ) په زیاتېدو سره، چې د اتوم د هستې شاوخوا الکترونونه په کلکه نیسي، له کیڼ څخه ښي خوا ته د آیونایزېشن انرژي زیاتیږي.
- په ډلو کې: له پاسه لاندې خواته ته د الکتروني قشرونو د شمېر د زیاتېدو له امله، چې الکترون له هستوي اغیزې څخه لرې ساتي، د آیونایزېشن انرژي کمیږي.
- نجیب ګازونه: د الکتروني مدارونو د بشپړ ظرفیت له امله، ډېره لوړه آیونایزېشن انرژي لري. په دې منځ کې، هیلیوم په ټولو عناصرو کې تر ټولو لوړه آیونایزېشن انرژي لري.
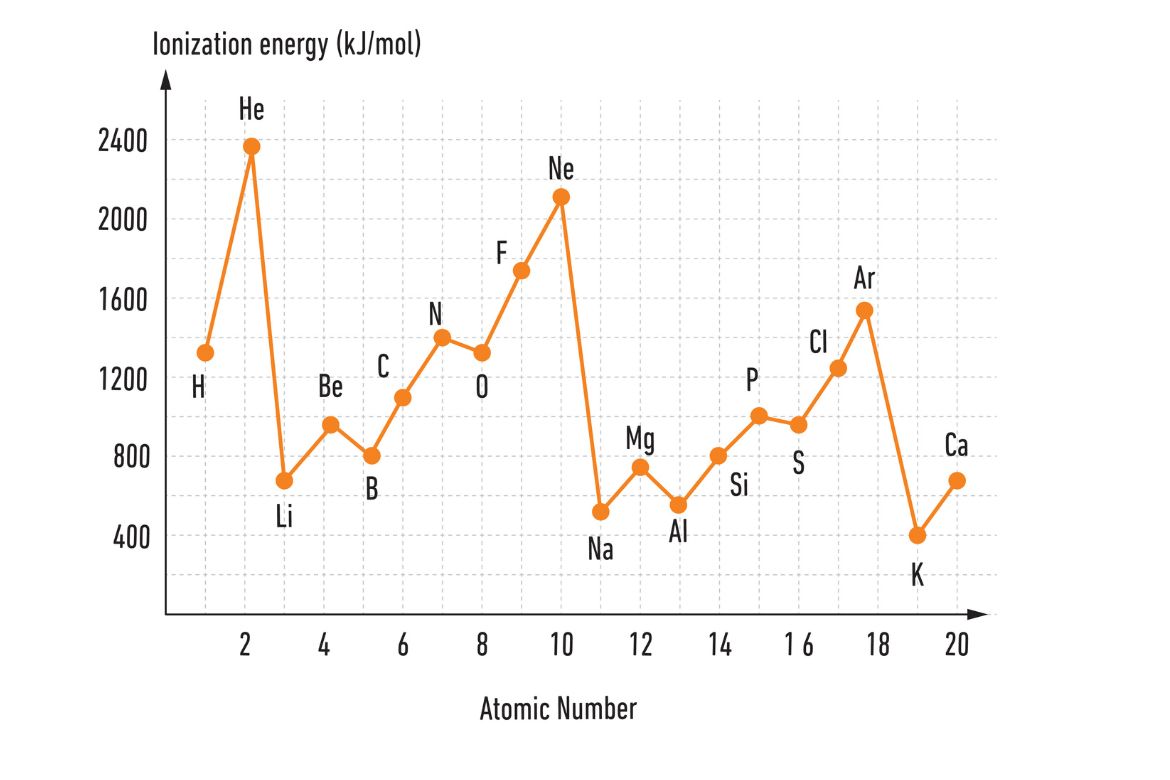
په لاندې جدول کې د یو شمېر عناصرو لپاره د آیونایزېشن انرژي اندازه (په کیلوژول واحد) د اتومي نمبر په پام کې نیولو سره ښودل شوې ده.
 الکترون غوښتنه (Electron Affinity)
الکترون غوښتنه (Electron Affinity)
الکترونخواهی، لکه څنګه چې له نوم څخه یې څرګندیږي، د یوه اتوم توانایي ده چې یو الکترون ومني. د الکترونيګاتيويتي برعکس، الکترونغوښتنه یو کمیتي (Quantitative) خاصیت دی او په ګازي بې طرفه اتوم کې د الکترون د اضافه کولو پر مهال د انرژي بدلون څرګندوي. هر څومره چې د الکترونغوښتنې مقدار منفي وي، په هماغه اندازه د اتوم لیوالتیا د الکترون جذبولو ته زیاته وي. په بل عبارت، هغه انرژي چې په بې طرفه ګازي اتوم یا مالیکول کې د الکترون د اضافه کولو او منفي آیون د جوړولو پر مهال آزاد کیږي، الکترون غوښتنه بلل کیږي.
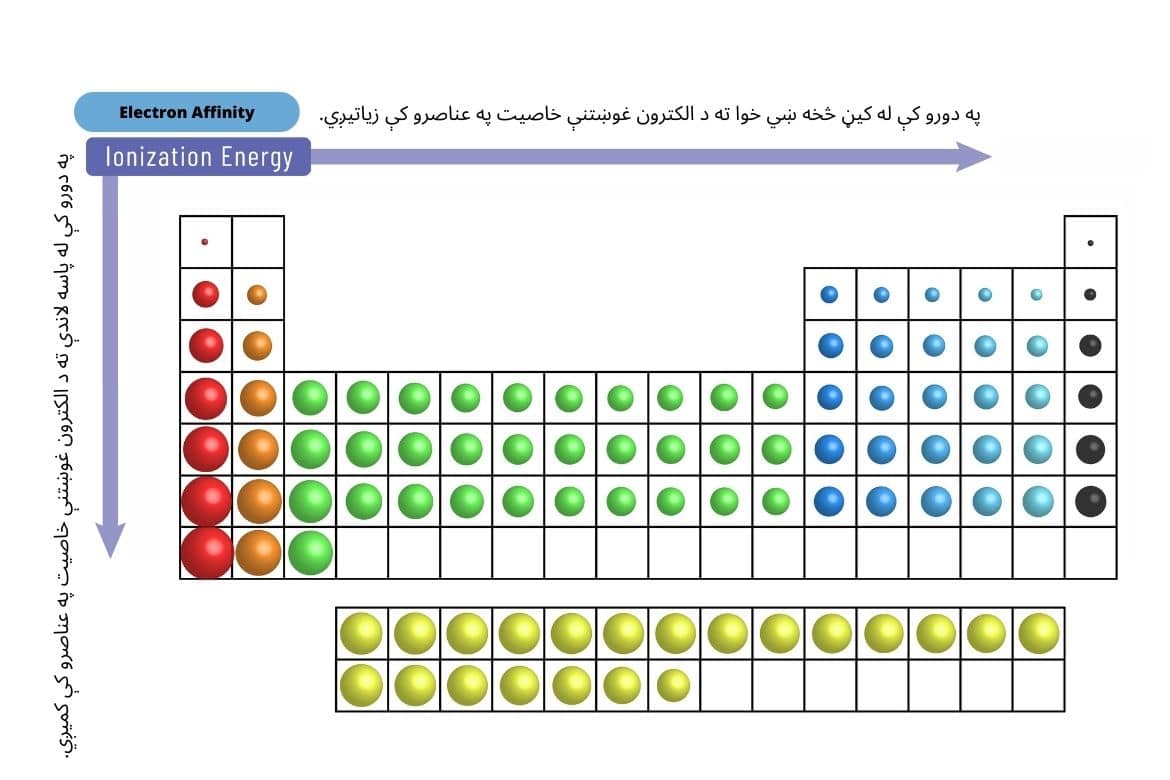 په لنډه توګه د الکترون غوښتنې خاصیت بدلون:
په لنډه توګه د الکترون غوښتنې خاصیت بدلون:
- په دورو کې: له کیڼ څخه ښي خوا ته د الکترون غوښتنې خاصیت په عناصرو کې زیاتیږي. دلیل یې د اتومونو د هستوي چارچ زیاتوالی دی چې الکترونونه په اسانۍ سره جذبوي.
- په ډلو کې: له پاسه لاندې ته دا خاصیت کمیږي. دلیل یې د اتوم د هستې شاوخوا د انرژي قشرونو یا سویو د شمېر زیاتوالی دی چې پر الکترونونو د هستوي چارچ کم اغیز لامل کیږي.
د غیرفلزاتو په منځ کې، هلوجنونه (د اوومې اصلي ډلې عناصر) لوړه الکترون غوښتنه لري. د فلزاتو په منځ کې، د لومړۍ او دویمې اصلي ډلې (القلي فلزات او القلي زمکني فلزات) عناصر کمزورې الکترونغوښتنه لري.
- نجیب ګازونه: په ټولو عناصرو کې ډېر کمزوری الکترون غوښتنې خاصیت لري ځکه چې د هغوی وروستی الکتروني مدار بشپړ دی.
په دې ویډیو کې هم د عناصرو د تناوبي جدول د ځانګړتیاوو مفصل تشریح شوې ده، لکه: الکترونگاتویتی، الکتروپوزیتیویتی، د آیونایزیشن انرژي، او د الکترونخواهی ځانګړنه.