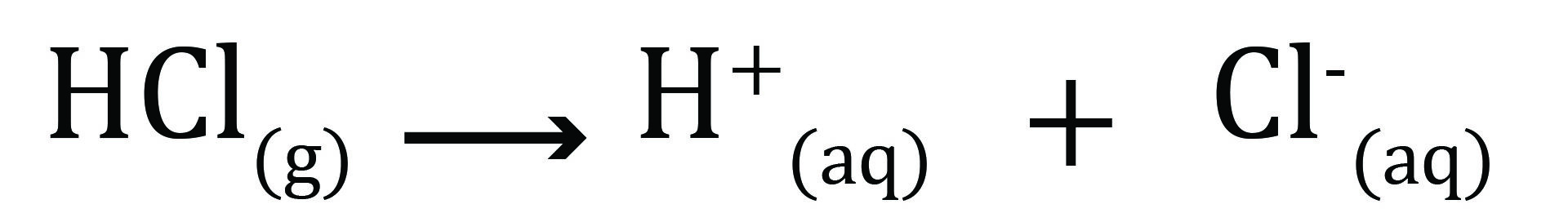تېزابونه او القلي ګانې (Acids and Bases)
تېزابونه (Acids): هغه مرکبونه دي چې په اوبو محلول کې پروتون(آیون+H) تولیدوي یا په کیمیاوي تعاملاتو کې د الکترون جوړې اخیستونکي په توګه عمل کوي. د عامو تېزابونو څو بېلګې عبارت دي له: د سرکې تېزاب (استیک اسید، CH3COOH)، د معدې تېزاب (هایډروکلوریک اسید، HCl) او د لیمو تېزاب (سیتریک اسید،C6H8O7). تېزاب د لاتین کلمې ‘اسیدوس’ (Acidus) څخه اخیستل شوی چې معنی یې تروش دی. تېزابونه خورنده خاصیت لري، معرفونه (اندیکاتورونه) د رنګ بدلون ته اړ کوي او القلي ګانې خنثی کوي. تېزابونه تروش خوند لري. قلوي ګانې(Bases): د پروتون اخیستونکي (آیون+H) او یا د الکترون جوړې ورکوونکي وي. لکه: امونیا (NH3)، سوډیم هایدروکسایډ (NaOH)، د جوش شیرین (سوډیم بای کاربونیت، NaHCO3) ، پوتاشیم هایدروکسایډ (KOH) او نور.
قلوي ګانې(Bases): د پروتون اخیستونکي (آیون+H) او یا د الکترون جوړې ورکوونکي وي. لکه: امونیا (NH3)، سوډیم هایدروکسایډ (NaOH)، د جوش شیرین (سوډیم بای کاربونیت، NaHCO3) ، پوتاشیم هایدروکسایډ (KOH) او نور.
القلوي (Base) د لرغونی انګلیسي کلمې (Debase) څخه اخیستل شوي چې د کمولو یا کمښت معنا لري. کله چې اسیدونه او القلي مواد په ټاکلو نسبتونو سره یو ځای شي، القلي مواد د محلول په اړونده برخه کې د اسیدونو د مقدار کمښت لامل ګرځي، چې (Debase) کلمې سره سمون لري. القلي مواد تریخ خوند لري او د القلي موادو اوبه ییز محلولونه لشم وي.
قلوې ګانې په اوبو کې لږ حل کیږي، ځینې قلوې انې په اوبو کې حل کیږي، لکه: سوډیم هایدروکساید، پوتاشیم هایدروکساید، او امونیا.
تېزابونه او قلوې ګانې د بېلابېلو خاصیتونو په نظر کې نیولو سره، او د دوی د بېلابېلو تعاملاتو له مخې، د پوهانو له خوا په لاندې طریقو تعریف شوي دي.
د تېزابونو او قلوې ګانو تعریف د سوانت ارهینوس (Svante Arrhenius) پر بنسټ:
تېزابونه هغه مرکبات دي چې په اوبو محلول کې د هایدروجن آیون (+H) خوشې کوي. د هایدروجن آیون (+H) په آزاد ډول په محلول کې شتون نه لري، بلکه د هایدرونیوم آیون (+H3O) ته بدلیږي.
په لاندې معادله کې، هایدروکلوریک اسید په اوبو محلول کې ښودل شوی دی.
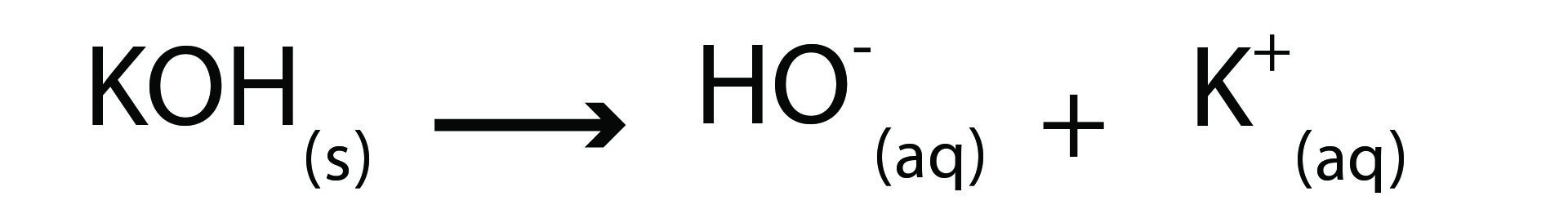
قلوې ګانې هغه مرکبات دي چې په اوبو محلول کې هایدروکساید آیون (–OH) خوشې کوي.
په لاندې معادله کې، پوتاشیم هایدروکساید قلوې په اوبو محلول کې ښودل شوی دی.
دا عمل یوازې هغو موادو ته محدود دی چې په اوبو کې حل کیدلی شي. (دا د ارهینوس تعریف یوه نیمګړتیا ده)
د برونستید – لوري (Bronsted-Lowry) نظریې پر اساس د تېزابونو او قلوې ګانو تعریف:
د برونستید- لوري نظریې پر اساس، تېزابونه هغه مواد دي چې په کیمیاوي تعاملاتو کې د (+H) پروتون ورکونکي دي، او قلوې ګانې هغه مواد دي چې په کیمیاوي تعاملاتو کې د (+H)پروتون اخیستونکي دي.
دا تعریف په خلاف د ارهینوس نظر څخه په غیر اوبو محلولونو کې هم کاریدلی شي.
لکه: په دې تعامل کې HCl د برونستید- لوري تېزاب په توګه عمل کوي، ځکه چې پروتون ورکوي، او NH3 د برونستید- لوري قلوې په توګه عمل کوي، ځکه چې پروتون اخلي.
په دې تعامل کې HCl د برونستید- لوري تېزاب په توګه عمل کوي، ځکه چې پروتون ورکوي، او NH3 د برونستید- لوري قلوې په توګه عمل کوي، ځکه چې پروتون اخلي.
په لاندې کیمیاوي معادله کې، اوبه او امونیا د برونستید-لوري پر اساس د تېزاب او القلي په توګه تعریف شوي دي.
 په دې تعامل کې، اوبه د برونستید- لوري تېزاب په توګه عمل کوي، ځکه چې پروتون ورکوي، او NH3 د برونستید-لوري القلي په توګه عمل کوي، ځکه چې پروتون اخلي.
په دې تعامل کې، اوبه د برونستید- لوري تېزاب په توګه عمل کوي، ځکه چې پروتون ورکوي، او NH3 د برونستید-لوري القلي په توګه عمل کوي، ځکه چې پروتون اخلي.
د ګیلبرټ نیوټن لیوس (Gilbert Newton Lewis) نظریې پر اساس د تېزابونو او القلي ګانو تعریف:
القلي ګانې هغه مواد دي چې کولی شي خپل آزاد الکترونونه جوړه له لاسه ورکړي، او تېزابونه هغه مواد دي چې الکترون جوړه اخلي.
+H د لویس تېزاب په توګه عمل کوي، ځکه چې د H2O څخه الکترون جوړه اخلي.
H2O د لویس القلي په توګه عمل کوي، ځکه چې الکترون جوړه ورکوي.
نوت: ډیری کتیونونه لکه Al+3 کولی شي د لویس تېزاب په توګه عمل وکړي، پداسې حال کې چې ډیری انیونونه لکه –F کولی شي د لویس القلي په توګه عمل وکړي.
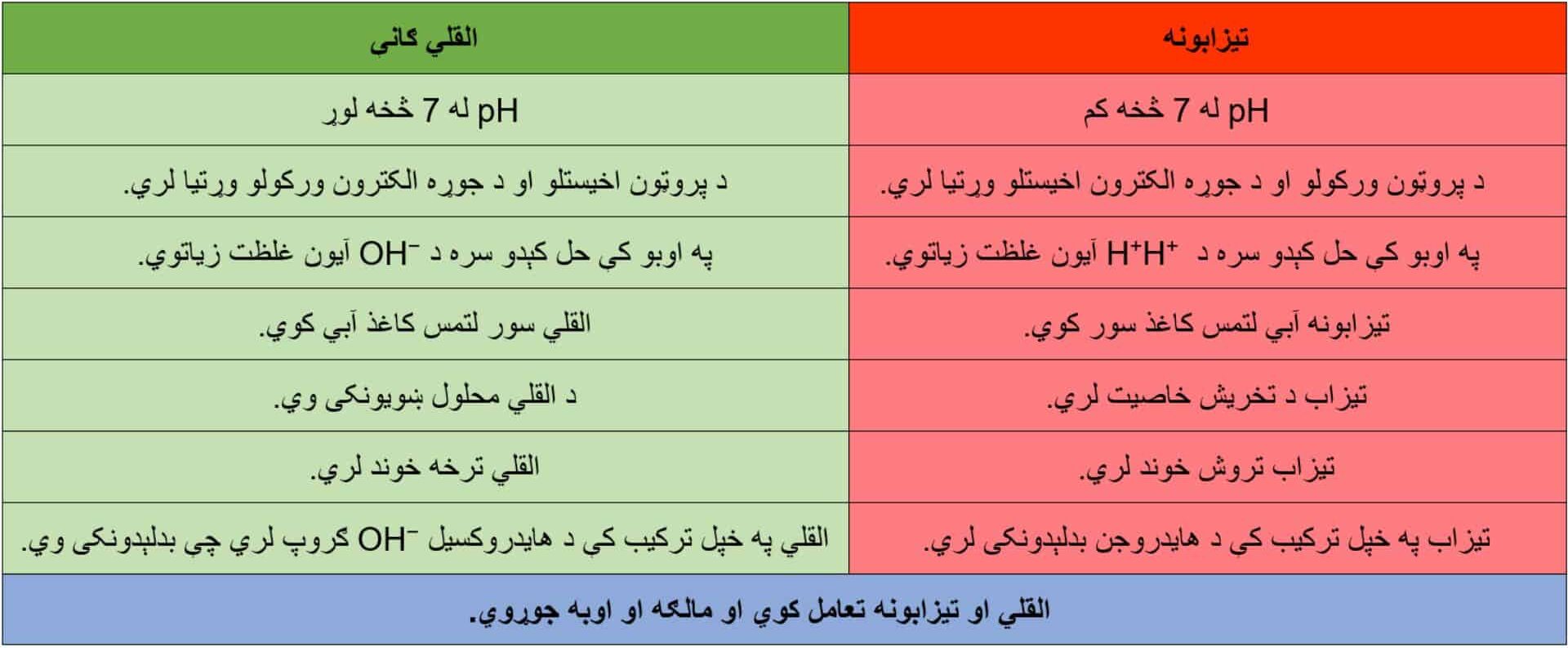
د تېزابونو او القلي ګانو ځانګړتیاوې: په لاندې جدول کې، د فزیکي او کیمیاوي ځانګړتیاوو له مخې، د تېزاب او القلي ګانو یو شمېر توپیرونه بیان شوي دي.